
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
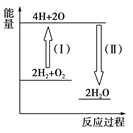
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
【答案】 N2H4(l) + 2H2O2(l)=N2(g) + 4H2O(g) ΔH=-640 kJ·mol-1 408 不产生污染性物质 2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1 放出 1852
【解析】(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,则1mol液态肼放出的热量为256kJ/0.4mol=640kJ·mol-1,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ·mol-1;(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ·mol-1;②H2O(g)===H2O(l) ΔH=-44 kJ·mol-1;依据盖斯定律①+②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-816kJ·mol-1,而16g液态肼物质的量为0.5mol,与液态双氧水反应生成液态水时放出的热量=0.5mol×816kJ·mol-1=408kJ;(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 不产生污染性物质;(4)已知:①N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1 , ②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 ,依据盖斯定律②×2-①得到,气态肼和二氧化氮反应的热化学方程式为:2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1;(4)形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量,因此放出能量为4×463kJ=1852kJ。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)═Si(s)+4HCl(g)△H=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述中正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(Lmin)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置可以达到实验目的的是( )
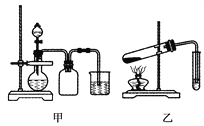
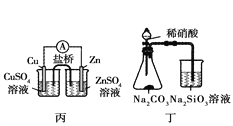
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于氧化还原反应的是( )
A.CaCO3== CaO + CO2↑B.NH3+ HCl = NH4Cl
C.NaOH + HCl = NaCl +H2OD.Zn + H2SO4(稀)= ZnSO4+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) ![]() 2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | ____ |
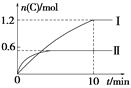
A. 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B. 上述方程式中a=160
C. 600℃时,该反应的平衡常数是0.45
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.纯碱溶液清洗油污,加热可增强其去污能力
B.门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料
C.聚丙烯酸钠是一种高吸水性树脂
D.汽油、煤油、植物油都是油,但它们的主要成分不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则![]() 的值减小
的值减小
C. 向NaHS溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
D. 将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合(忽略体积、温度变化),所得溶液中c(Na+)=c(CH3COO-),则醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,下列说法正确的是
A. O4和O2互为同位素
B. 同温同压下,等体积的O4气体和O2气体含有相同的分子数
C. 18O是氧元素的一种核素,它的中子数是8
D. O4转化O2为物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com