
【题目】工业上制备高纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)═Si(s)+4HCl(g)△H=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述中正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(Lmin)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
【答案】D
【解析】解:A、从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误; B、该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C、反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)= ![]() =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)= ![]() ×v(HCl)=
×v(HCl)= ![]() ×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
D、由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为 ![]() ×4=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
×4=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
A、从压强对平衡移动的影响分析;
B、注意反应的可逆性;
C、根据反应速率之比等于化学计量数之比分析;
D、根据方程式计算生成HCl的物质的量.


科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: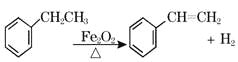 ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列图表和有关要求回答问题:
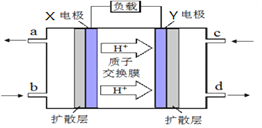
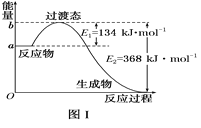
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 4.0 g H218O中所含电子数为2 NA
B. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
C. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
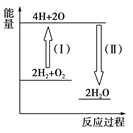
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com