
【题目】按照下列图表和有关要求回答问题:
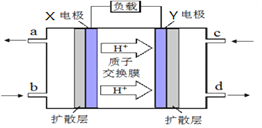
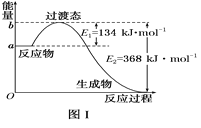
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
【答案】 减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 -99 +41 CH3OH-6e-+H2O ===CO2+6H+ Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol
【解析】(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)Ⅰ.反应热=反应物总键能-生成物总键能,故△H1=1076kJmol-1+2×436kJmol-1 -(3×413+343+465)kJmol-1 =-99kJmol-1,根据盖斯定律:反应②-反应①=反应③,故△H3 =△H2-△H1 =-58kJmol-1-(-99kJmol-1)=+41kJmol-1,故答案为:-99;+41;
Ⅱ.根据氢离子移动方向知,X是负极、Y是正极,该原电池是燃料电池,则X电极上甲醇失电子发生氧化反应、Y电极上氧气得电子发生还原反应,X电极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O =CO2+6H+,故答案为:CH3OH-6e-+H2O =CO2+6H+;
(3)X与Z两元素的单质分别为Si、氯气,二者反应生成的最高价化合物为四氯化硅,已知该化合物的熔、沸点分别为-69℃和58℃,则室温下四氯化硅为液态,则该反应的热化学方程式为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.05mol某烃A后,将燃烧产物依次通过足量浓硫酸、碱石灰,试验结束后,称得浓硫酸增重5.4g,碱石灰增重11g.则:
(1)该烃的分子式为;属于烃.
(2)写出烃A所有可能存在的结构简式;
(3)若烃A的一氯取代产物只有一种,写出A与氯气反应(第一步)的化学方程式;
(4)下列烃中,属于A的同系物,且其一氯代物可能只有一种的是; A:C3H8 B:C2H4 C:C8H18 D:C6H14
(5)在120°C和101Kpa的条件下,某气态烃和一定质量的氧气混合点燃,完全反应后再恢复到原来的温度时,气体体积不变,则该烃可能是 .
A.CH4
B.C2H2
C.C2H4
D.C2H6 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述状态下可导电的是;
属于电解质的是;
属于非电解质的是 .
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑨在水中的电离方程式为 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 热稳定性:HI>HBr>HCl B. 元素非金属性:P>S>Cl
C. 原子半径:S>C1>F D. 碱性:Mg(OH)2>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( ) 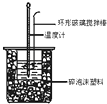
A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)═Si(s)+4HCl(g)△H=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述中正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(Lmin)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置可以达到实验目的的是( )
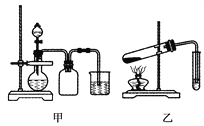
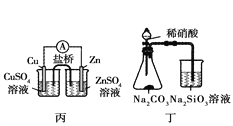
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com