
【题目】燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.05mol某烃A后,将燃烧产物依次通过足量浓硫酸、碱石灰,试验结束后,称得浓硫酸增重5.4g,碱石灰增重11g.则:
(1)该烃的分子式为;属于烃.
(2)写出烃A所有可能存在的结构简式;
(3)若烃A的一氯取代产物只有一种,写出A与氯气反应(第一步)的化学方程式;
(4)下列烃中,属于A的同系物,且其一氯代物可能只有一种的是; A:C3H8 B:C2H4 C:C8H18 D:C6H14
(5)在120°C和101Kpa的条件下,某气态烃和一定质量的氧气混合点燃,完全反应后再恢复到原来的温度时,气体体积不变,则该烃可能是 .
A.CH4
B.C2H2
C.C2H4
D.C2H6 .
【答案】
(1)C5H12;烷
(2)CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C
(3)(CH3)4C+Cl2→(CH3)3CCH2Cl+HCl
(4)C
(5)AC
【解析】解:(1)完全燃烧0.05mol某烃A后,将燃烧产物依次通过足量浓硫酸、碱石灰,试验结束后,称得浓硫酸增重5.4g,碱石灰增重11g,可知n(H2O)= ![]() =0.3mol,n(CO2)=
=0.3mol,n(CO2)= ![]() =0.25mol,则有机物中N(C)=
=0.25mol,则有机物中N(C)= ![]() =5,N(H)=2×
=5,N(H)=2× ![]() =12,故分子式为C5H12 , 所以答案是:C5H12;烷;(2)C5H12可存在正戊烷、异戊烷、新戊烷3种同分异构体,其结构简式为:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,
=12,故分子式为C5H12 , 所以答案是:C5H12;烷;(2)C5H12可存在正戊烷、异戊烷、新戊烷3种同分异构体,其结构简式为:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,
所以答案是:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C;(3)烃A的一氯取代产物只有一种,为(CH3)4C,与氯气反应(第一步)的化学方程式为(CH3)4C+Cl2→(CH3)3CCH2Cl+HCl,
所以答案是:(CH3)4C+Cl2→(CH3)3CCH2Cl+HCl;(4)属于A的同系物,应为烷烃,且其一氯代物可能只有一种,则结构对称,只含有1中H,可为(CH3)3CC(CH3)3 , 所以答案是:C;(5)生成的水为气体,反应前后气体体积不变,由CxHy+(x+ ![]() )O2=xCO2+
)O2=xCO2+ ![]() H2O,则1+x+
H2O,则1+x+ ![]() =x+
=x+ ![]() ,解得y=4,即烃分子中H原子数目为4,故选项中CH4、C2H4 符合,
,解得y=4,即烃分子中H原子数目为4,故选项中CH4、C2H4 符合,
故选:AC.


科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚
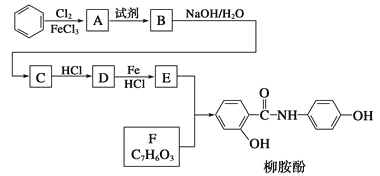
已知:![]()
回答下列问题:
(1)写出A→B反应所需的试剂______________,A→B反应类型为______________________。
(2)对于柳胺酚,下列说法正确的是___________。
A.1 mol柳胺酚最多可以和2 molNaOH反应 B. 可发生水解反应
C. 不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式__________________________________。
(4)写出化合物F的结构简式_____________________________。
(5)写出同时符合下列条件的F的同分异构体的结构简式________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素反应的能量变化图(反应物和生成物均为298 K时的稳定状态)。下列选项中不正确的是( )
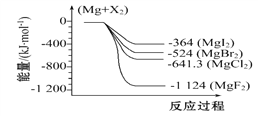
A. Mg与F2反应的ΔS<0 B. MgF2(s)+Br2(l)MgBr2(s)+F2(g)ΔH=+600 kJ·mol-1
C. MgBr2与Cl2反应的ΔH<0 D. 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因 .
(2)哪一段时段的反应速率最小 , 原因是 .
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水
B.CH3COONa固体
C.Na2CO3溶液
D.CuSO4溶液你认为可行的是(填编号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: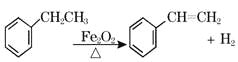 ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列图表和有关要求回答问题:
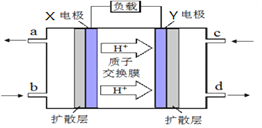
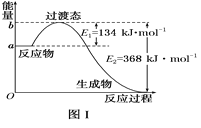
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com