
【题目】利用下列实验装置可以达到实验目的的是( )
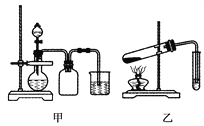
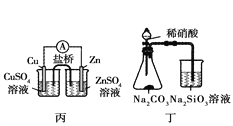
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
【答案】C
【解析】A、实验室可以采用KMnO4与浓盐酸在常温下反应制取Cl2,Cl2的密度大于空气的密度,采取向上排空气法收集Cl2,但集气瓶中的导气管应该长进短出,多余的Cl2可以用NaOH溶液吸收以防污染环境,A错误;B、加热条件下,乙醇和乙酸在浓硫酸的作用下发生酯化反应生成乙酸乙酯,收集乙酸乙酯时用饱和碳酸钠溶液吸收,乙酸乙酯中含有挥发出的乙酸和乙醇,乙酸和乙醇易溶于水,所以导气管不能伸入液面下,否则会引起倒流,B错误;丙装置中Zn比Cu活泼,Zn与Cu2+能发生自发的氧化还原反应,盐桥构成闭合回路,故可以形成Cu—Zn原电池,C正确;D、硝酸与碳酸钠反应产生的CO2气体与硅酸钠溶液反应生成白色沉淀H2SiO3,但硝酸是一种挥发性的酸,挥发出的硝酸也能与硅酸钠溶液反应产生白色沉淀H2SiO3,因此不能确定沉淀的生成是CO2引起的还是HNO3引起的,故无法证明H2CO3的酸性大于H2SiO3,本实验中如果用稀硫酸代替硝酸就可以证明H2CO3的酸性大于H2SiO3,D错误。正确答案为C。


科目:高中化学 来源: 题型:
【题目】按照下列图表和有关要求回答问题:
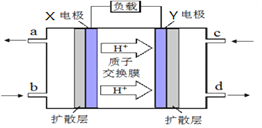
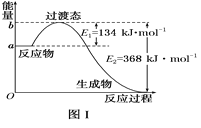
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等症状,以致死亡。该外毒素为环状肽,其结构简式如图所示:

请据图分析回答:
(1)该化合物中含有游离的___________个氨基,___________个羧基。
(2)该化合物是由___________个氨基酸组成的,区别这些氨基酸的种类依靠的是其结构中的___________。
(3)组成该化合物的氨基酸有_________种,其中有_______个氨基酸的R基相同,这个R基是________。
(4)该化合物为___________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A.______________________, B.______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
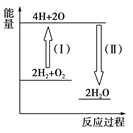
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
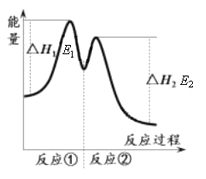
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com