
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
【答案】D
【解析】解:Cu(OH)2从组成上可看成CuOH2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4 , 并电解了0.1 mol H2O,由电解的总反应式:
2H2O+ | 2CuSO4 |
| 2Cu+ | O2↑+ | 2H2SO4 | 转移电子 |
2mol | 4mol | |||||
0.1mol | 0.2mol |
2H2O |
| 2H2↑+ | O2↑ | 转移电子 |
2mol | 4mol | |||
0.1mol | 0.2mol |
所以电解过程中共转移电子为0.4 mol.
故选:D.
根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电.


科目:高中化学 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq).一定温度下,下列有关该反应的推理正确的是( )
A.该反应达到平衡时c(Cu2+)=c(Mn2+)
B.平衡体系中加入少量CuS(s)后,c(Mn2+)变小
C.平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应的平衡常数K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置可以达到实验目的的是( )
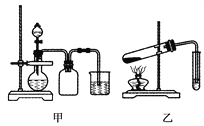
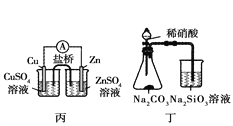
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)![]() 2C(g);△H>0 。达到平衡后,改变一个条件(x),下列量(y)一定符合右图中曲线的是( )
2C(g);△H>0 。达到平衡后,改变一个条件(x),下列量(y)一定符合右图中曲线的是( )

x | y | |
A | 再加入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于氧化还原反应的是( )
A.CaCO3== CaO + CO2↑B.NH3+ HCl = NH4Cl
C.NaOH + HCl = NaCl +H2OD.Zn + H2SO4(稀)= ZnSO4+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可能在有机物的分子中引入羟基官能团的反应类型有:①氧化反应②取代反应 ③消去反应 ④加成反应 ⑤水解反应.其中正确的组合有( )
A.①②③
B.②③⑤
C.②④⑤
D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com