
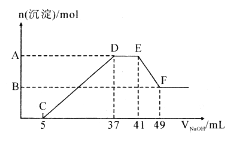
【题目】现有一定量的镁铝合金与100 mL 稀硝酸充分反应,在反应过程中无气体放出。在反应结束后的溶液中,逐滴加入1.00mol/ L NaOH溶液,加入NaOH 溶液的体积与产生沉淀的物质的量关系如图所示:
(1)合金中的铝与稀硝酸反应的化学方程式为_________;
(2)纵坐标上A 点数值是__________,B 点数值是_________;
(3)原HNO3 溶掖的物质的量浓度为_________。
【答案】 8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O 0.012 0.004 0.45mol/L
【解析】在镁铝与稀硝酸反应后的混合溶液中滴加1.00mol/ L NaOH溶液,当沉淀量最多时,继续滴加NaOH溶液,最初沉淀量不减少,说明溶液中含有NH4+,发生的离子反应为NH4++OH-=NH3·H2O;
(1)合金中铝与稀硝酸反应生成硝酸铝和硝酸铵,发生反应的化学方程式为8Al+30HNO3=8Al(NO3)3+3NH4NO3+9H2O;
(2)EF阶段发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,消耗NaOH的物质的量为(49mL-41mL)×10-3L/mol×1.00mol/ L=0.008mol,则生成Al(OH)3的物质的量为0.008mol,CD段发生离子反应生成Mg(OH)2 和Al(OH)3,共消耗NaOH的物质的量为(37mL-5mL)×10-3L/mol×1.00mol/ L=0.032mol,则生成Mg(OH)2 的物质的量为(0.032mol-0.008mol×3)÷2=0.004mol,故纵坐标A点生成沉淀的总物质的量为0.008mol+0.004mol=0.012mol,B点为Mg(OH)2 的物质的量为0.004mol;
(3)DE段消耗NaOH的物质的量为(41mL-37mL)×10-3L/mol×1.00mol/ L=0.004mol,则溶液中含有NH4NO3的物质的量为0.004mol,D点溶液为NaNO3和NH4NO3的混合溶液,NaNO3的物质的量等于D点加入NaOH的总物质的量,即为37mL×10-3L/mol×1.00mol/ L=0.037mol,根据原子守恒可知,原硝酸的物质的量为0.037mol+0.004mol×2=0.045mol,HNO3 溶掖的物质的量浓度为![]() =0.45mol/L。
=0.45mol/L。


科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,全部由过渡元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.超导材料K3C60
D.荧光材料硫化锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如下图所示。下列说法正确的是
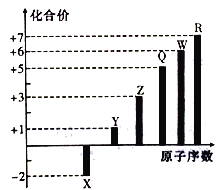
A. X、Y、R形成的某种化合物可以用于漂白、消毒
B. Q元素形成的可溶性盐的溶液不可能显酸性
C. X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X
D. Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A,C两元素最高价氧化物的水化物相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3﹣的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO3的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g) ,达到平衡,正反应速率随时间变化如图所示。则正确的结论是
SO3(g)+NO(g) ,达到平衡,正反应速率随时间变化如图所示。则正确的结论是
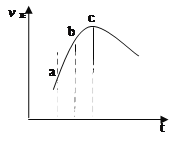
A. 逆反应速率:a点小于点c
B. 反应物浓度:a点小于点b
C. 反应在c点时处于平衡状态
D. 反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示: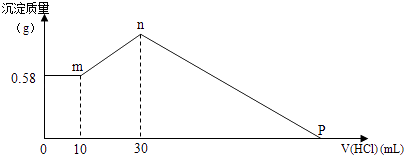
(1)混合物中NaOH的质量是g,AlCl3的质量是g.
(2)P点所表示盐酸加入体积为mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com