
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A,C两元素最高价氧化物的水化物相互反应的离子方程式为 .
【答案】
(1)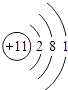
(2)第三周期ⅢA族
(3)离子键
(4)Al(OH)3+OH﹣═AlO2﹣+2H2O
【解析】解:、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族; A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为: ![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;B元素的单质跟D元素单质反应生成化合物BD2 , B为+2价,则D为﹣1价,所以D为Cl元素,(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为:
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;B元素的单质跟D元素单质反应生成化合物BD2 , B为+2价,则D为﹣1价,所以D为Cl元素,(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为: 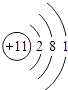 ,所以答案是:
,所以答案是: 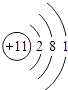 ;(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,所以答案是:第三周期ⅢA族;(3)MgCl2中镁离子和氯离子只存在离子键,所以答案是:离子键;(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.
;(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,所以答案是:第三周期ⅢA族;(3)MgCl2中镁离子和氯离子只存在离子键,所以答案是:离子键;(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.


科目:高中化学 来源: 题型:
【题目】某温度下,![]()
![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液![]() ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
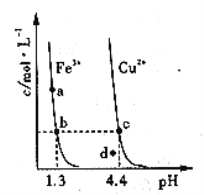
A.![]()
B.加适量![]() 固体可使溶液由
固体可使溶液由![]() 点变到
点变到![]() 点
点
C.![]()
![]() 两点代表的溶液中
两点代表的溶液中![]() 与
与![]() 乘积相等
乘积相等
D.![]() 、
、![]() 分别在
分别在![]() 、
、![]() 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃有两种或两种以上的同分异构体,其某一种同分异构体的一氯代物只有一种,则这种烃可能是( ) ①分子中含有7个碳原子的芳香烃 ②分子中含有4个碳原子的烷烃
③分子中含有12个氢原子的烷烃 ④分子中含有8个碳原子的烷烃.
A.③④
B.②③
C.①②
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y和Z三种元素,已知H3ZO4、H2YO4和HXO4的酸性依次增强,下列判断不正确的是( )
A.非金属性:X最强,Z最弱
B.气态氢化物稳定性:HX最强
C.X可能是氟元素
D.原子半径:Z最大,X最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾羅的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_____________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
向一定条件下的恒容密用容器中充入NO和CO,用传感器测得该反应在不同时间时NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(NO)=V(CO)
②此条件下达到平衡时,该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下, NaHSO3显___性 (填“酸”“碱”或“中”,判断的理由是(通过计算说明)______。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。
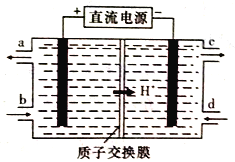
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与100 mL 稀硝酸充分反应,在反应过程中无气体放出。在反应结束后的溶液中,逐滴加入1.00mol/ L NaOH溶液,加入NaOH 溶液的体积与产生沉淀的物质的量关系如图所示:
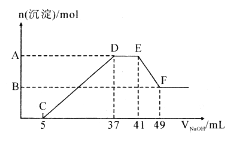
(1)合金中的铝与稀硝酸反应的化学方程式为_________;
(2)纵坐标上A 点数值是__________,B 点数值是_________;
(3)原HNO3 溶掖的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数约为6.02×1023mol﹣1 , 下列说法中一定正确的是( ) 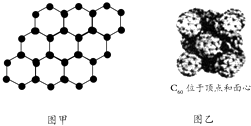
A.60 g SiO2晶体中含有2×6.02×1023个Si﹣O键
B.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图甲),则0.12 g石墨烯中含有6.02×1022个碳原子
C.720 g C60晶体(如图乙)中含有6.02×1023个晶胞结构单元
D.14 g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11- 0℃。
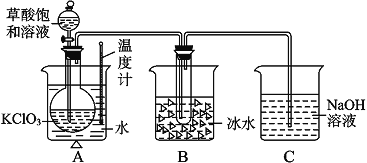
(1)配平该反应化学方程式:____KClO3+ H2C2O4== KHCO3+ ClO2↑
(2)B装置的作用是______________________ 。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com