
����Ŀ���ﶬ���������߷��ļ�������������β����ȼúβ����������_����Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H<0
N2(g)+2CO2(g) ��H<0
��һ�������µĺ������������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��ʱNO��CO��Ũ�����±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
c(CO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
�����п��жϷ�Ӧ�ﵽƽ��״̬����___________(����ĸ����)��
A.c(NO)���ٸı� B.c(NO)/c(CO)���ٸı�
C.c(NO)/c(CO2)���ٸı� D.V(NO)=V(CO)
���������´ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=________��
��Ϊ�����β��������Ч�����ɲ�ȡ�Ĵ�ʩ��________(д�����ּ���)��
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪:��������HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�������£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
���������� NaHSO3��___�� (�������������������������жϵ�������(ͨ������˵��)______��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ����������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ����������NO2-��NO3-���������ʵ���֮��Ϊ1:1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ��������ͬʱ����Ce4+����ԭ������ͼ��ʾ��
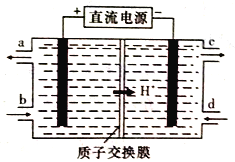
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��______________��
���𰸡� CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=һ867kJ/mol AC 2.56��105 �����¶ȣ�������ѹǿ(��ѹ�����)����ʹ�ô����Ը��õĴ�����(д�����ּ���) Na2SO3 �� ��ΪHSO3-�ĵ��볣��Ka2=5.8��10-8��ˮ�ⳣ��Kb=![]() ��8.3��10-13�����볣������ˮ�ⳣ����������Һ������ a 2NO2-+8H++6e-=N2��+4H2O
��8.3��10-13�����볣������ˮ�ⳣ����������Һ������ a 2NO2-+8H++6e-=N2��+4H2O
��������������Ҫ�����й�ƽ��״̬���жϺͼ��㡣
��1������֪�������Ȼ�ѧ����ʽ����ٳ���2�ɵü���ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=һ867kJ/mol��
��2����A.c(NO)���ŷ�Ӧ���ж��ı䣬��c(NO)���ٸı�ʱ��˵����Ӧ�ﵽƽ��״̬����A���жϷ�Ӧ�ﵽƽ��״̬��B.c(NO)/c(CO)��ƽ��״̬֮��û��һ����ϵ����B�����жϷ�Ӧ�ﵽƽ��״̬��C.c(NO/c(CO2)���ŷ�Ӧ���ж��ı䣬��c(NO/c(CO2)���ٸı�ʱ��˵����Ӧ�ﵽƽ��״̬����C���жϷ�Ӧ�ﵽƽ��״̬��D.V(NO)��V(CO)��������Ӧ���ʣ�����˵������Ӧ���ʵ����淴Ӧ���ʣ���D�����жϷ�Ӧ�ﵽƽ��״̬����ѡAC��
�ڴ������´ﵽƽ��ʱ��c(NO)=1.00��10-3mol/L��c(CO)=1.00��10-3mol/L��c(CO2)=8.00��10-3mol/L��c(N2)=4.00��10-3mol/L���÷�Ӧ��ƽ�ⳣ��K= 2.56��105��
2.56��105��
��Ϊ�����β��������Ч�����ɲ�ȡ�Ĵ�ʩ�н����¶ȣ�������ѹǿ(��ѹ�����)����ʹ�ô����Ը��õĴ�����
��3���ٳ����£�HNO2�ĵ��볣��Ka=7��10-4>H2SO3�ĵ��볣��Ka2=5.8��10-8��������ͬŨ�ȵ�ˮ��̶�Na2SO3>NaNO2��pH�ϴ����Na2SO3��Һ��
�ڳ����£�NaHSO3�����ԣ��жϵ���������ΪHSO3-�ĵ��볣��Ka2=5.8��10-8��ˮ�ⳣ��Kb=![]() ��8.3��10-13�����볣������ˮ�ⳣ����������Һ��������
��8.3��10-13�����볣������ˮ�ⳣ����������Һ��������
��4����Ce4+������������������ɣ��ӵ��۵�a��������
������������ԭ��Ӧ��������NO2-ת��ΪN2�������ĵ缫��Ӧʽ��2NO2-+8H++6e-=N2��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ý������WirthResearch��˾����������������ȼ�ϵ����Ϊ��Ҫ��Դ�����˿���ϵͳ(UAS)����ƣ���������ȼ�ϵ�ر���ͨ�����ӵ�ؾ��и��ߵ������ܶ�(�����ܶ���ָ��λ������������Դ洢����������)����������H2��̼���ܵȲ��������Ķ��ε�ص�ԭ������ͼ��ʾ���õ�ص��ܷ�ӦΪH2+2NiO(OH) ![]() 2Ni(OH)2����֪:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-������˵������ȷ����
2Ni(OH)2����֪:6NiO(OH)+NH3+H2O+OH-=6Ni(OH)2+NO2-������˵������ȷ����
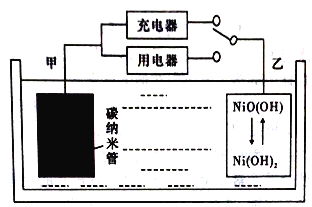
A. ̼��������H2���ܶ�Խ��ص������ܶ�Խ��
B. ��ؿ�����KOH��Һ����ˮ����Ϊ�������Һ
C. �ŵ�ʱ.�ҵ缫��ӦΪNiO(OH)+H2O+e-=Ni(OH)2+OH-
D. ���ʱ����ص�̼�缫��ֱ����Դ�ĸ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ʧ���Ӷ�Ľ�����ԭ��ǿ
B. ���������ӱ���ԭ��һ���õ���������
C. ijԪ�شӻ���̬������̬����Ԫ��һ������ԭ
D. ���������ڷ�Ӧ��ֻ������ԭ�����ǽ�������ֻ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
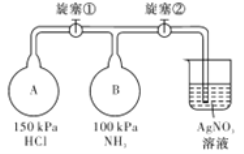
����Ŀ��������ͼװ��(�г�װ����ʡ��)��ȡ���ռ�����������İ�������̽�����������ʡ�

��1����μ���װ��I��������?___________________��
��2������װ��I��ȡ������Ӧѡ�õ��Լ�Ϊ___(����ĸ����)��
A.Ũ��ˮ B.Ũ���� C.����� D.��ʯ�� E.��������
��3������ʵ��Ҫ�����������ӵ�˳��Ϊ:a��___��___��___��___��___(����ĸ���ű�ʾ)��____________
��4��������ͨ��ʢ������ͭ��ĩ�IJ��������������к�ɫ�������ɫ���嵥�����ɡ�֤����������______����������Ӧ�Ļ�ѧ����ʽ��________________��
��5���ռ�����������ͼ��ʾ����װ�ý���ʵ�顣�ȴ������٣�Bƿ�в�����ɫ���̣�ԭ����_______________(�û�ѧ����ʽ��ʾ)���ȶ������ر������٣��ٴ������ڣ�Bƿ�е�������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��ͬһ���ڵ�����Ԫ�أ�A��B��C��ԭ�������������1��AԪ�صĵ��ʻ�ѧ��������ã�����ˮֱ�ӷ�����Ӧ��BԪ�ص�������2.0gǡ�ø�100mL0.5mol/L��H2SO4��ȫ��Ӧ��BԪ�صĵ��ʸ�DԪ�ص��ʷ�Ӧ����BD2�ͻ��������������ʵ�ش�
��1��Aԭ�ӵĽṹʾ��ͼΪ
��2��C�����ڱ��е�λ�ã�
��3��BD2���еĻ�ѧ������Ϊ
��4��A��C��Ԫ������������ˮ�������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���տ˷�Ӧ(Heckreaction)���л���ѧ��Ӧ���нϹ㷺��Ӧ�ã�ͨʽ�ɱ�ʾΪ��R-X+R��-CH=CH2![]() R��-CH=CH-R+HX(R-X�е�Rͨ���Dz�������������R��-CH=CH2ͨ���DZ�ϩ�������ϩ���)
R��-CH=CH-R+HX(R-X�е�Rͨ���Dz�������������R��-CH=CH2ͨ���DZ�ϩ�������ϩ���)
��֪A�����������ķ���������A��B��C��D���л�������������ת����ϵ�����ַ�Ӧ��������Ӧ������ʡ������
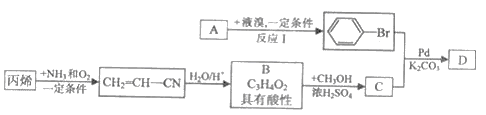
��ش��������⡣
��1����ӦI�ķ�Ӧ������______��������C��������______��
��2��д��B�����ⷴӦ�Ļ�ѧ����ʽ__________��
��3��д��D�Ľṹ��ʽ(�����������칹)��________________������D�ķ�Ӧ����Ҫ����K2CO3�����Ǽ���KOH����Ŀ����_______________��
��4��д������������(�Ⱦ�����������ʹ������Ȼ�̼��Һ��ɫ)��C��ͬ���칹��Ľṹ��ʽ(�����������칹)��_______________��
��5�������ᱽ�����ȿ����������ϡ�ʳƷ���Ӽ���һЩ���ϵ��ܼ���Ҳ�����������ϡ�Ϳ�ϵ����ܼ����������������ƽ괯��д����A�����ͬϵ���Ʊ������ᱽ����(![]() )�ĺϳ�·��������������Լ���Ϊ��������ϳ�·�߳��õı�ʾ��ʽΪ
)�ĺϳ�·��������������Լ���Ϊ��������ϳ�·�߳��õı�ʾ��ʽΪ ��__________________________
��__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������о��������������̬����̬����������Ҫ������ʯӢ���У���ʯӢ�⣬SiO2������ʯӢ�ͷ�Ӣʯ�ȶ��ֱ��壮��Ӣʯ�ṹ�ͽ��ʯ���ƣ���ṹ��Ԫ��ͼ�������й�˵����ȷ���ǣ� �� 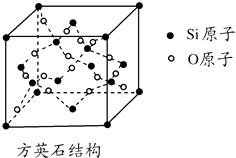
A.��Ӣʯ�����д�����SiO4�ṹ��Ԫ
B.1 mol Si�γ�2 mol Si��O��
C.��ͼ��ʾ�Ľṹ��Ԫ��ʵ��ռ��18����ԭ��
D.��Ӣʯ�����У�Si��O��֮��ļн�Ϊ90��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL����״��������Ӧ�����Һ�м���1.0mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵���в���ȷ���ǣ� ��
A.NO2��N2O4�Ļ�������У�NO2�����������80%
B.��Ũ������HNO3�����ʵ���Ũ����14.0mol/L
C.�úϽ���ͭ��þ�����ʵ���֮����2��1
D.�õ�2.54g����ʱ������NaOH��Һ�������600mL
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com