
【题目】下列说法正确的是( )
A. 失电子多的金属还原性强
B. 金属阳离子被还原不一定得到金属单质
C. 某元素从化合态到游离态,该元素一定被还原
D. 金属单质在反应中只能作还原剂,非金属单质只能作氧化剂
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性. 物质 ![]() 有光学活性,发生下列反应:
有光学活性,发生下列反应:
①与乙酸发生酯化反应 ②与NaOH水溶液反应 ③在Cu作催化剂时与O2反应 ④与银氨溶液反应.发生哪些反应后生成的有机物无光学活性(填写符合题意的字母编号)
A.只有①②
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ②④⑤
C. ①④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃有两种或两种以上的同分异构体,其某一种同分异构体的一氯代物只有一种,则这种烃可能是( ) ①分子中含有7个碳原子的芳香烃 ②分子中含有4个碳原子的烷烃
③分子中含有12个氢原子的烷烃 ④分子中含有8个碳原子的烷烃.
A.③④
B.②③
C.①②
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 常温下电离常数为Ka的酸HA的溶液中c(H+)=![]() mol/L
mol/L
C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的c(H+)=10-7mol/L
D. 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y和Z三种元素,已知H3ZO4、H2YO4和HXO4的酸性依次增强,下列判断不正确的是( )
A.非金属性:X最强,Z最弱
B.气态氢化物稳定性:HX最强
C.X可能是氟元素
D.原子半径:Z最大,X最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾羅的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_____________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
向一定条件下的恒容密用容器中充入NO和CO,用传感器测得该反应在不同时间时NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(NO)=V(CO)
②此条件下达到平衡时,该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下, NaHSO3显___性 (填“酸”“碱”或“中”,判断的理由是(通过计算说明)______。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。
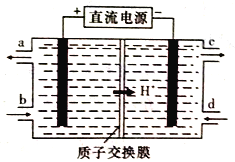
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数约为6.02×1023mol﹣1 , 下列说法中一定正确的是( ) 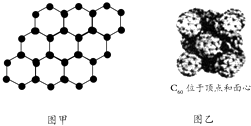
A.60 g SiO2晶体中含有2×6.02×1023个Si﹣O键
B.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图甲),则0.12 g石墨烯中含有6.02×1022个碳原子
C.720 g C60晶体(如图乙)中含有6.02×1023个晶胞结构单元
D.14 g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42﹣、OH﹣、K+
B.Fe3+、NO3﹣、Cl﹣、H+
C.K+、CO32﹣、Cl﹣、H+
D.H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com