
����Ŀ��������ͼװ��(�г�װ����ʡ��)��ȡ���ռ�����������İ�������̽�����������ʡ�

��1����μ���װ��I��������?___________________��
��2������װ��I��ȡ������Ӧѡ�õ��Լ�Ϊ___(����ĸ����)��
A.Ũ��ˮ B.Ũ���� C.����� D.��ʯ�� E.��������
��3������ʵ��Ҫ�����������ӵ�˳��Ϊ:a��___��___��___��___��___(����ĸ���ű�ʾ)��____________
��4��������ͨ��ʢ������ͭ��ĩ�IJ��������������к�ɫ�������ɫ���嵥�����ɡ�֤����������______����������Ӧ�Ļ�ѧ����ʽ��________________��
��5���ռ�����������ͼ��ʾ����װ�ý���ʵ�顣�ȴ������٣�Bƿ�в�����ɫ���̣�ԭ����_______________(�û�ѧ����ʽ��ʾ)���ȶ������ر������٣��ٴ������ڣ�Bƿ�е�������________________��
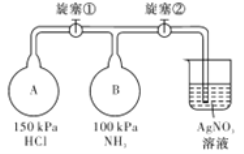
���𰸡� �ر�ֹˮ�кͷ�Һ©������,���Һ©���м�������ˮ����Һ©��������һ��ʱ���Һ©����Һ�汣�ֲ����Һ�岻�ٵ��£�˵��װ��I���������� AD(��AE) c b e f d ��ԭ 2NH3+3CuO![]() N2+3H2O+3Cu HCl+NH3=NH4Cl �ձ��е�AgNO3��Һ�ᵹ������Bƿ��,������ɫ����
N2+3H2O+3Cu HCl+NH3=NH4Cl �ձ��е�AgNO3��Һ�ᵹ������Bƿ��,������ɫ����
����������1��װ��I�к��з�Һ©��������������Եķ����ǹر�ֹˮ�кͷ�Һ©�����������Һ©���м�������ˮ����Һ©��������һ��ʱ���Һ©����Һ�汣�ֲ����Һ�岻�ٵ��£�˵��װ��I���������á���2������װ��I��ȡ��������Ӧ����Ҫ���ȣ�Ӧѡ�õ��Լ�ΪŨ��ˮ����ʯ�һ�Ũ��ˮ���������ƣ���3��������Ҫ��ʯ�Ҹ���ܶ�С�ڿ�����Ӧ���������ſ������ռ���������������ˮ��β������ʱ��Ҫ��ֹ���������������ӵ�˳��Ϊa��c��b��e��f��d����4��������ͨ��ʢ������ͭ��ĩ�IJ������У������к�ɫ�������ɫ���嵥�����ɣ���ɫ������ͭ�����������ǵ�������˵���������л�ԭ�ԣ�������Ӧ�Ļ�ѧ����ʽ��2NH3+3CuO![]() N2+3H2O+3Cu����5���ȴ������٣�Bƿ�в�����ɫ���̣�ԭ���ǰ������Ȼ��⻯�������Ȼ�泥���Ӧ�Ļ�ѧ����ʽΪHCl+NH3��NH4Cl���ȶ��ر������٣��ٴ������ڣ�����ѹǿ���ͣ���������Һ��������B�У��������ӷ�Ӧ�����Ȼ�������Bƿ�е��������ձ��е�AgNO3��Һ�ᵹ������Bƿ�У�������ɫ������
N2+3H2O+3Cu����5���ȴ������٣�Bƿ�в�����ɫ���̣�ԭ���ǰ������Ȼ��⻯�������Ȼ�泥���Ӧ�Ļ�ѧ����ʽΪHCl+NH3��NH4Cl���ȶ��ر������٣��ٴ������ڣ�����ѹǿ���ͣ���������Һ��������B�У��������ӷ�Ӧ�����Ȼ�������Bƿ�е��������ձ��е�AgNO3��Һ�ᵹ������Bƿ�У�������ɫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵������ȷ���ǣ�������
A.1 mol N2�����е�ԭ����ΪNA
B.��״���£�22.4 Lˮ�к��е�ˮ������ΪNA
C.��״���£�22.4 L�Ȼ���������ԭ����ΪNA
D.24 g O2���Ӻ�24 g O3������������ԭ����Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ�� Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ ������һ������һ����С�����������Ҳ���ܼ�С����
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g�� +H2O��g�� ![]() CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
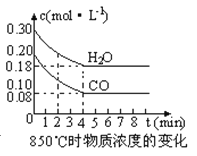
ʱ����min�� | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t��������850����ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ���
�ٱ���3min��4min֮�䷴Ӧ���� ״̬��c 1��ֵ 0.08 mol��L-1 ������ڡ�С�ڻ��������
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ���� ����ѡ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� ����ѡ����
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����ʵ���Ũ�ȵ�NH4HSO4��Һ��NaOH��Һ�������ϣ���Һ�и�����Ũ�ȴ�С��ϵΪc(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. �����µ��볣��ΪKa����HA����Һ��c(H+)=![]() mol/L
mol/L
C. ������ͬŨ�ȵ�ǿ���ǿ����Һ�������Ϻ���ˮ�������c(H+)=10-7mol/L
D. ��֪298Kʱ������(HCN)��Ka=4.9��10-10��̼���Ka1=4.4��10-7��Ka2=4.7��10-11���ݴ˿��Ʋ������������뵽̼������Һ���ܹ۲쵽�����ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��Al3+��Cl-��SO42-��CO32-��AlO2-�е����������ӡ�����Ũ�Ⱦ�Ϊ0.3mol��L-1��ijͬѧ����������ʵ�飺

����˵����ȷ����
A. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
B. ԭ��Һ�д��ڵ�����ΪNH4+��Fe2+��Cl-��SO42-
C. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
D. ��ȷ������C�ijɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ﶬ���������߷��ļ�������������β����ȼúβ����������_����Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H<0
N2(g)+2CO2(g) ��H<0
��һ�������µĺ������������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��ʱNO��CO��Ũ�����±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
c(CO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
�����п��жϷ�Ӧ�ﵽƽ��״̬����___________(����ĸ����)��
A.c(NO)���ٸı� B.c(NO)/c(CO)���ٸı�
C.c(NO)/c(CO2)���ٸı� D.V(NO)=V(CO)
���������´ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=________��
��Ϊ�����β��������Ч�����ɲ�ȡ�Ĵ�ʩ��________(д�����ּ���)��
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪:��������HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�������£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
���������� NaHSO3��___�� (�������������������������жϵ�������(ͨ������˵��)______��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ����������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ����������NO2-��NO3-���������ʵ���֮��Ϊ1:1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ��������ͬʱ����Ce4+����ԭ������ͼ��ʾ��
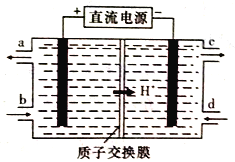
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������˫��ˮ��ҽ������������ɱ����������������ϴ�˿ڡ���ʱ����Ϊ��ҵ��Һ���������С���ɫ�������������ơ�
��1����ƽ���л�ѧ��Ӧ�����õ����ű�ʾ����ת�Ƶķ������Ŀ������ƽ�͵����Ÿ�ռ������
[ ]H2O2+[ ]Cr2(SO4)3+[ ]KOH��[ ]K2CrO4+[ ]K2SO4+[ ]H2O
��2���������ɿ�ҵ��Һ�е��軯���KCN��CΪ+2�ۣ��������·�Ӧʵ�֣�KCN+H2O2+H2O=A+NH3����
��ָ��A�Ļ�ѧʽ ����˷�Ӧ����6.72L����״�����������ɣ�ת�Ƶ�����ĿΪ ����NA��ʾ����
��3���������Ҳ������ҽѧɱ�����������ݷ�Ӧ�������ж�������������������ǿ����������
MnO2+4HCl(Ũ)![]() MnCl2+C12��+2H2O��
MnCl2+C12��+2H2O��
2KMnO4+16HCl(Ũ)=2MnCl2+5C12��+8H2O��
��Mn02��KMnO4������ ǿ��
ijǿ�ᷴӦ��ϵ�У���Ӧ��������ﹲ�������ʻ����ӣ�O2��MnO4-��H2O��Mn2+��H2O2��H+����֪�÷�Ӧ��H2O2 ֻ���������¹��̣�H2O2��O2����÷�Ӧ�з�����ԭ��Ӧ�Ĺ����ǣ�_________��_________���÷�ӦӦѡ������ǣ�_________������ţ���
A������ B��Ũ���� C��ϡ���� D������
��4����0.2 mol/L Na2SO3��Һ32 mL����ԭ��4��10��3 mol XO42������Һ��������Na2SO3��0.2mol/L KMnO4������Һ����(����KMnO4����ԭ��Mn2+)��������KMnO4��Һ0.8 mL����Ԫ��X�ڻ�ԭ�����еĻ��ϼ����� ��
A��+1 B��+2 C��+3 D��+4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С����������洢װ�õ��ŵ㡣һ������(N2H4)Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Ϊ����ʡ����й��ڸ�ȼ�ϵ�ص���������ȷ����( )

A. �������Ҳ�缫�������غ��������缫
B. ���������ĵ缫��ӦʽΪN2H4��4OH����4e��===N2����4H2O
C. ��ȼ�ϵ�صĵ缫����Ӧ���ö������ϣ�����ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�
D. ��ȼ�ϵ�س����ŵ�ʱ��K���Ӹ���������Ǩ�ƣ�������ӽ���Ĥ��ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о���Ҫ�������ǣ�������
������һ�����ʵ���Ũ�ȵ���Һ����pH ��ֽ��ʹ�ã������ˣ���������
A. �Թ� B. ��ͷ�ι� C. ©�� D. ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com