
【题目】我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
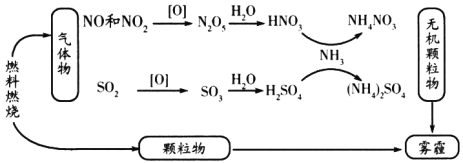
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO2转化为SO3的化学方程式________________________。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。
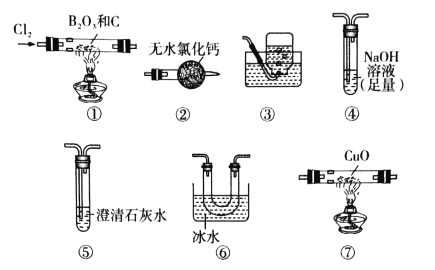
已知:i.实验室制备BCl3的化学方程式为:B2O3+3C+3Cl2![]() 2BCl3+3CO;
2BCl3+3CO;
ii.BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl。下列说法不正确的是
A.实验装置合理的连接顺序为①⑥④②⑦⑤③
B.装置④中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
C.装置⑥的作用是冷凝并收集BCl3
D.验证有CO生成的现象是装置⑦中CuO由黑色变成红色,且装置⑤中澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量![]() 通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
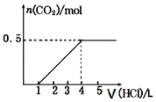
A.通入的![]() 气体为
气体为![]() L
L
B.A溶液中既含有NaOH,又含有Na2CO3
C.A溶液中n(NaHCO3) =2 n(Na2CO3)
D.盐酸浓度为2/3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
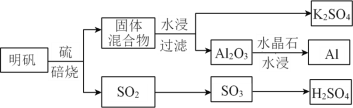
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是葡萄酒中常用的抗氧化剂。一种以硫黄为原料制取Na2S2O5的生产工艺如下:
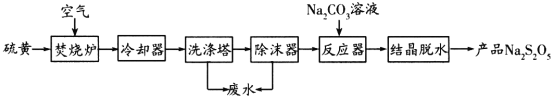
已知:结晶脱水发生的反应:![]()
回答下列问题:
(1)Na2S2O5中硫元素的化合价为________。
(2)焚烧炉中反应的化学方程式为________________。
(3)反应器中发生反应的离子方程式为________________。
(4)葡萄酒酿造过程中添加Na2S2O5会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的常用试剂是________________。
(5)废水中的硫单质(S8)能与碱反应,化学反应:![]() ,反应中氧化剂与还原剂的物质的量之比为________。
,反应中氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10.00mL0.1000mol·L-1H2SO4溶液中滴加相同物质的量浓度的氨水,测得混合溶液中-lgc(OH-)随滴加氨水体积的变化如图所示,下列说法错误的是
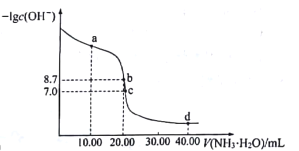
A.水的电离程度:b>c>a
B.Kh(NH4+)的数量级为10-10
C.c点满足c(SO42-)>c(NH4+)>c(H+)=c(OH-)
D.d点满足c(NH4+)+2c(H+)=c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
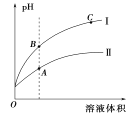
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com