
【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
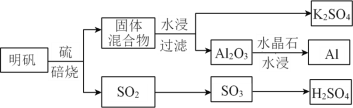
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
【答案】4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O 四 ⅠA 2 1s22s22p63s23p5 > > < < 3 V形 sp2 CH3COOH存在分子间氢键 16 ![]()
【解析】
明矾和硫混合焙烧生成SO2和固体混合物,用水溶解固体并过滤得到滤渣Al2O3、滤液K2SO4,利用电解Al2O3可制得Al,SO2催化氧化生成SO3,再溶于水可制得硫酸。利用均摊法先确定晶胞的组成,得到晶胞的质量,再结合![]() 计算。
计算。
(1)明矾和硫混合焙烧生成SO2、K2SO4和Al2O3,则结合守恒法,发生反应的化学方程式为4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O;
(2)K的核电荷数为19,核外电子排布式为1s22s22p63s23p64s1,则K位于元素周期表第四周期第ⅠA族;
(3)S的核电荷数为16,价电子轨道表达式为![]() ,则基态S原子核外有2个未成对电子;Cl的核电荷数为17,基态Cl原子核外电子排布式为1s22s22p63s23p5;
,则基态S原子核外有2个未成对电子;Cl的核电荷数为17,基态Cl原子核外电子排布式为1s22s22p63s23p5;
(4)同主族元素,随着原子序数的增加,原子核对核外电子的吸引力减弱,第一电离能减小,则第一电离能:O>S;核外电子排布相同的离子,核电荷数越大,离子半径越小,则离子半径:Cl->K+;钾离子半径大于铝离子半径,铝离子半径大于氧离子半径,所以Al2O3的熔点高于KCl的熔点,故熔点:KCl<Al2O3;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,则酸性:H2SO4<HClO4;
(5)SO2的价层电子对个数是2+![]() =3,S原子为sp2杂化,孤对电子数是1,该分子为结构为V形;SO3中硫原子价层电子对个数是3+
=3,S原子为sp2杂化,孤对电子数是1,该分子为结构为V形;SO3中硫原子价层电子对个数是3+![]() =3,无孤对电子,采用杂化方式sp2;
=3,无孤对电子,采用杂化方式sp2;
(6)乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
(7)Al单质为面心立方晶体,以顶点Al原子研究,其配原子处于面心位置,顶点为8个晶胞共用,面心为2个晶胞共用,则晶胞中Al原子数目=8×![]() +6×
+6×![]() =4,Al原子总质量=4×
=4,Al原子总质量=4×![]() g
g![]() g)÷(0.405×10-7 cm)3=
g)÷(0.405×10-7 cm)3=![]() gcm-3。
gcm-3。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】铍作为一种新兴材料日益被重视,是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。铍及其化合物大多具有毒性。如图是以一种已经预处理后的含铍矿绿柱石(主要含有![]() ,
,![]() ,
,![]() ,
,![]() 和
和![]() 等)为原料制取单质铍的工艺流程:
等)为原料制取单质铍的工艺流程:
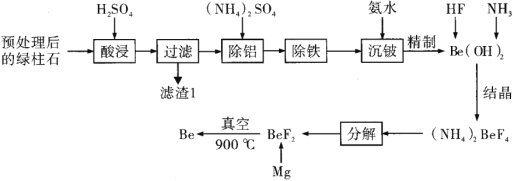
已知:i.铍和铝的化学性质相似;
ii.氯化铍在融熔态时较难电离;
iii.Be(OH)2在![]() 时会溶解;
时会溶解;
iV.![]() 。
。
(1)滤渣1的主要成分是________。
(2)在“除铝”过程中铝会以铝铵矾![]() 的形式析出,则此过程中生成铝铵矾的化学方程式为________。
的形式析出,则此过程中生成铝铵矾的化学方程式为________。
(3)“除铁”过程要求不引入新的杂质,其操作应为________。
(4)在“沉铍”过程中,若改为加入过量的![]() 溶液,则铍的存在形式是________(填离子符号)。
溶液,则铍的存在形式是________(填离子符号)。
(5)在“分解”过程中产生的![]() 烟气会发生反应:
烟气会发生反应:![]() ,可用
,可用![]() 代替
代替![]() 用于雕刻玻璃,反应过程中有
用于雕刻玻璃,反应过程中有![]() 生成,请写出此反应的化学方程式:________。
生成,请写出此反应的化学方程式:________。
(6)工艺中采用氟化铍镁热还原法制取铍需要真空环境的原因是________。氯化铍熔盐电解法也可以制取铍,但是在电解过程中需要加入等量的![]() ,加入
,加入![]() 的作用是________。
的作用是________。
(7)铍铜因具有良好的导电性、导热性、耐腐蚀性、耐热冲击性以及无磁性、无火花等特性而成为最为广泛使用的一种铍合金。若绿柱石中![]() 的含量为a%,上述工艺流程中
的含量为a%,上述工艺流程中![]() 的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
(8)工艺流程中产生的含有![]() 的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
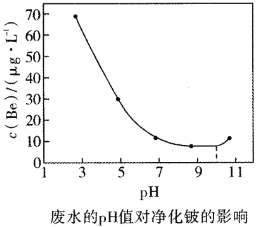
A.9~11,30℃ B.7~10,30℃ C.8~11,35℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置正确且能达到对应实验目的的是
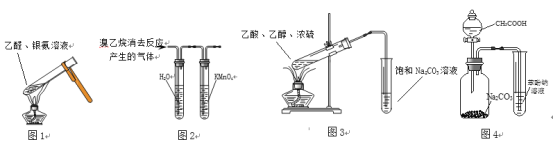
A. 用图1装置进行银镜反应
B. 用图2装置检验溴乙烷消去后的产物是否含乙烯
C. 用图3装置制备乙酸乙酯
D. 用图4装置比较乙酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,硫酸应属于____________
①酸 ②化合物③含氧酸④电解质⑤能导电的纯净物⑥二元酸⑦混合物
A.①③④⑤⑥ B.①②③④⑥ C.①②③⑤⑥⑦D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法不正确的是( )。
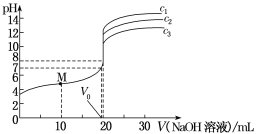
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)=![]() [c(A-)-c(HA)]+c(OH-)
[c(A-)-c(HA)]+c(OH-)
C.恰好中和时,三种溶液的pH相等
D.由pH=7的溶液计算得:Ka=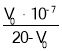 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式________,存在的化学键类型有________________。
(2)写出HClO电子式________________,写出CO2的结构式_______。
(3)含有共价键的离子化合物是_______(填序号)
(4)用电子式表示CaBr2的形成过程_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
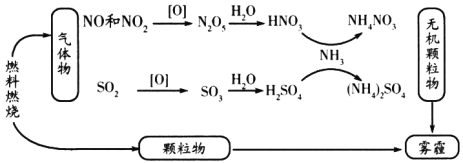
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO2转化为SO3的化学方程式________________________。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)是一种不稳定的酸,易分解为NO2和NO;其盐亚硝酸钠是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质,常用作漂白剂、媒染剂。回答下列问题:
(1)亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的功能而使人体中毒。一旦发生亚硝酸盐中毒,立即注射美蓝溶液进行治疗,推断美蓝溶液具有________(填“氧化”或“还原”)性。
(2)亚硝酸钠外观极像食盐,和食盐一样有咸味。工业上常用下列两种方法检验食盐中是否混有亚硝酸钠。
①取样品,加稀硫酸,若观察到________(填现象),说明样品中含有亚硝酸钠。
②取样品,加________溶液(填试剂名称),酸化后溶液变蓝,说明样品中含有亚硝酸钠。
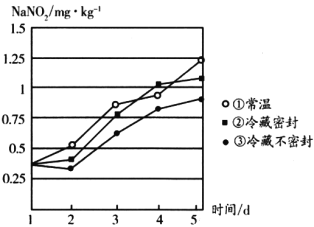
(3)研究不同条件下保存萝卜,发现亚硝酸钠含量随时间变化如图所示,若要保证在亚硝酸钠含量低于1mg·kg-1时食用,则三种条件下保存时间由长到短的顺序是________(填序号)。
(4)鱼塘中亚硝酸钠浓度过高,鱼不吃食甚至死亡。可用适量二氧化氯(ClO2)处理亚硝酸钠,ClO2被还原为Cl-,反应的离子方程式为________________________;若有3mol ClO2参与反应,则转移电子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
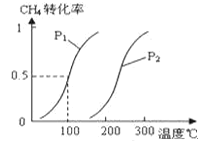
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为______。
②在其它条件不变的情况下升高温度,化学平衡常数将_______(填“增大”“减小”或“不变”)。
③图中的P1_____P2(填“<”、“>”或“=”),100℃时平衡常数为________。
④保持反应体系为100℃,5min后再向容器中充入H2O、H2各0.5mol,化学平衡将向_____移动(填“向左”“向右”或“不”)。
(2)在压强为0.1MPa条件下,将amolCO与3amol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H_____0,△S_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可以提高CO转化率的是______。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1molCO和3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com