
����Ŀ��������(HNO2)��һ�ֲ��ȶ����ᣬ�ֽ�ΪNO2��NO����������������һ����Ҫ�Ļ���ԭ�ϣ����������������������ӵȻ�ԭ�����ʣ�������Ư����ýȾ�����ش��������⣺
(1)�������ƻ��������е�Ѫ�쵰�����ã�������������Ϊ���������Ӷ�ʹѪ�쵰��ɥʧ���������Ĺ��ܶ�ʹ�����ж���һ���������������ж�������ע��������Һ�������ƣ��ƶ�������Һ����________(���������ԭ��)�ԡ�
(2)����������ۼ���ʳ�Σ���ʳ��һ������ζ����ҵ�ϳ����������ַ�������ʳ�����Ƿ�����������ơ�
��ȡ��Ʒ����ϡ���ᣬ���۲쵽________(������)��˵����Ʒ�к����������ơ�
��ȡ��Ʒ����________��Һ(���Լ�����)���ữ����Һ������˵����Ʒ�к����������ơ�
(3)�о���ͬ�����±����ܲ��������������ƺ�����ʱ��仯��ͼ��ʾ����Ҫ��֤���������ƺ�������1mg��kg-1ʱʳ�ã������������±���ʱ���ɳ����̵�˳����________(�����)��
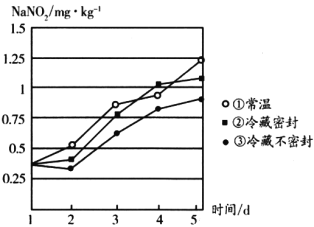
(4)��������������Ũ�ȹ��ߣ��㲻��ʳ��������������������������(ClO2)�����������ƣ�ClO2����ԭΪCl-����Ӧ�����ӷ���ʽΪ________________________������3mol ClO2���뷴Ӧ����ת�Ƶ��ӵ����ʵ�����________��
���𰸡���ԭ ��Һ�������� ���۵⻯����Һ �ۢ٢� ![]() 15mol
15mol
��������
�����ۺϿ����������ἰ�������ε����ʣ�����ʱ�ɴ���+3�۵Ļ��ϼ۳�����+3�ۿ����ɽ�ʹ����ܵ����������ܵ���ԭ�������������ỹ��һ�����ᡣ
��1����Ҫ�ⶾ�ɽ�Ѫ�쵰���е�![]() ���»�ԭΪ
���»�ԭΪ![]() �����������ҺӦ���л�ԭ�ԣ�
�����������ҺӦ���л�ԭ�ԣ�
��2���������������ᣬ����������������ᷴӦ���Եõ�![]() ��
��![]() ���ȶ��ַֽ����
���ȶ��ַֽ����![]() ��
��![]() ����˿��Թ۲쵽���ݣ�
����˿��Թ۲쵽���ݣ�
��Ҳ�ɴ��������Գ�����������۵⻯����Һ���������οɽ������ӱ�Ϊ���ʵ⣬���ʵ������۱�������֤����
��3����ͼ���Կ�����Ҫ�ﵽ![]() ��������ز��ܷ���ʱ�������ܷ���ʱ��̣���˱���ʱ���ɳ�����Ϊ�ۢ٢ڣ�
��������ز��ܷ���ʱ�������ܷ���ʱ��̣���˱���ʱ���ɳ�����Ϊ�ۢ٢ڣ�
��4���������ȵ����������������Ƶ���ԭ�������ӷ���ʽΪ��![]() ��
��![]() �ڷ�Ӧ����+4�۽��͵�-1�ۣ����ÿ��
�ڷ�Ӧ����+4�۽��͵�-1�ۣ����ÿ��![]() ��5�����ӣ�3mol
��5�����ӣ�3mol![]() �ڷ�Ӧ��һ��ת��15mol���ӡ�
�ڷ�Ӧ��һ��ת��15mol���ӡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ��ԭ�Ϻͻ����Լ���������״��ϳɼ��Ĵ��������¡�����˵��������ȷ����
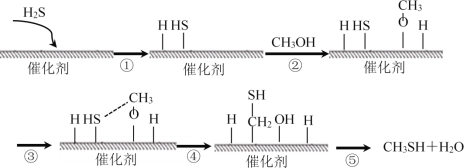
A.CH3SH��̼Ԫ�ػ��ϼ�Ϊ��2��
B.���̢��У��γ���O��H����C��H��
C.�ô�������Ч��߷�Ӧ���ƽ��ת����
D.������״��ϳɼ��ķ�Ӧ����Ϊȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K��Al��Cu��H��C��O��S��Cl�dz����İ���Ԫ�ء�
(1)������[KAl(SO4)2��12H2O]�Ʊ� Al��K2SO4��H2SO4�Ĺ�������ͼ��ʾ��
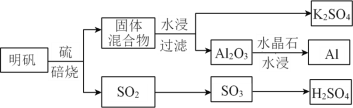
���������Ļ�ѧ����ʽΪ_________________________________________________��
(2)Kλ��Ԫ�����ڱ���________���ڵ�________�塣
(3)S�Ļ�̬ԭ�Ӻ�����________��δ�ɶԵ��ӣ�Cl�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ____________��
(4)�á�����������գ�
��һ������ | ���Ӱ뾶 | �۵� | ���� |
O____S | Cl��____K�� | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2�ļ۲���ӶԸ�����________���÷���Ϊ�ṹΪ________��SO3����ԭ�Ӳ����ӻ���ʽΪ___________��
(6)���Ʊ���Cu(OH)2�ɽ���ȩ���������ᣬ��������ԭ��Cu2O������ķе����Ը�����ȩ������Ҫԭ����____________________��Cu2OΪ�뵼����ϣ��������������ڲ���4����ԭ�ӣ�������ԭ��λ�����ĺͶ��㣬��þ�������________��ͭԭ�ӡ�
(7)Al����Ϊ�����������壬�侧������a=0.405 nm����ʽ��ʾAl���ʵ��ܶ�__________g��cm��3(�г�����ʽ�ӣ����ؼ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Na2S2O5)�����Ѿ��г��õĿ���������һ�������Ϊԭ����ȡNa2S2O5�������������£�
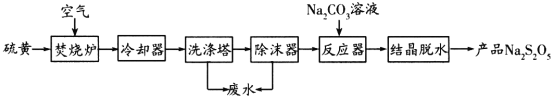
��֪���ᾧ��ˮ�����ķ�Ӧ��![]()
�ش��������⣺
(1)Na2S2O5����Ԫ�صĻ��ϼ�Ϊ________��
(2)����¯�з�Ӧ�Ļ�ѧ����ʽΪ________________��
(3)��Ӧ���з�����Ӧ�����ӷ���ʽΪ________________��
(4)���Ѿ��������������Na2S2O5��ų�һ���д̼�����ζ�����壬��������һ��ʳƷ���Ӽ���ʵ�����м��������ij����Լ���________________��
(5)��ˮ�е�����(S8)����Ӧ����ѧ��Ӧ��![]() ����Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
����Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����10.00mL0.1000mol��L-1H2SO4��Һ�еμ���ͬ���ʵ���Ũ�ȵİ�ˮ����û����Һ��-lgc��OH-����μӰ�ˮ����ı仯��ͼ��ʾ������˵���������
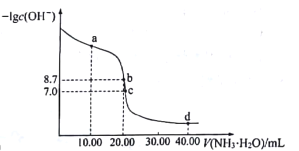
A.ˮ�ĵ���̶ȣ�b>c>a
B.Kh��NH4+����������Ϊ10-10
C.c������c��SO42-��>c��NH4+��>c��H+��=c��OH-��
D.d������c��NH4+��+2c��H+��=c��NH3H2O��+2c��OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС������֤��Ӧ��![]() ����ʵ���м�Fe3+�����ֺ�̽���������£�
����ʵ���м�Fe3+�����ֺ�̽���������£�
�������ữ��0.05mol��L-1��������Һ(pH��2)�м���������ۣ�����Ƭ�̣��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
(1)̽����Ӧ����
��ȡ�ϲ���Һ���������Ը��������Һ�У���Һ��ɫ��ȥ��˵����Һ�к��е�������________(д��ѧʽ)��
��ȡ������ɫ���壬ϴ�Ӻ�ϡ�����ܽ���壬�ټ����ᣬ�۲쵽________��֤����ɫ�����к���Ag��
(2)�ԡ���Һ�ʻ�ɫ������̽��
�ټ���Ϊ��Һ����Fe3+������Ϊ���۹���ʱ��������Fe3+���ҵ�������________(�����ӷ���ʽ��ʾ)��
�ڶ�Fe3+������ԭ���������¼��裺
��������е�O2��Fe2+������
�����������Һ��![]() ���������ԣ���Fe2+������
���������ԣ���Fe2+������
�������Һ�е�________��Fe2+������
��ʵ����֤��
�����������ữ��NaNO3��Һ(pH��2)�м���������ۣ�������ã�ȡ��ͬʱ����ϲ���Һ�μ�KSCN��Һ��3minʱ��Һ��dz��ɫ��30min����Һ������ɫ��
�������������ϲ���Һ�м���________��Һ���к�ɫ�������������ϲ���Һ�еμ�KSCN��Һ����Һ��졣
���ۺ�����ʵ���֪������________(�����)��ȷ������Fe2+�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ�����ᡢ̼���������ĵ���ƽ�ⳣ�����±���
���� | ̼�� | ������ |
Ka=1.75��10-5 | Ka1=4.30��10-7 Ka2=5.61��10-11 | Ka1=1.54��10-2 Ka2=1.02��10-7 |
��1��д��̼��ĵڶ�������ƽ�ⳣ������ʽ![]() _____________
_____________
��2������ͬ�����£��ԱȽϴ��ᡢ̼��������������ǿ��____ > ____ > ____��____
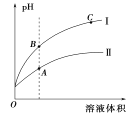
��3��ͼ��ʾ����ʱϡ�ʹ��ᡢ̼���������ϡ��Һʱ����ҺpH��ˮ���ı仯��
��ͼ���У�����I��ʾ������____���ѧʽ����
��A��B��C�����У�ˮ�ĵ���̶�������____������ĸ��
��4��ͬc(H+)ͬ����ĵĴ����������Һ�ֱ������������кͣ����������������ʵ����ϴ���� _________________________.
��5�����������鲻�ܴ����������_____________________________��
A. H2SO3��HCO3�� B. HSO3����CO32�� C.HSO3����HCO3�� D. HCO3����SO32�� E.H2SO3��CO32�� F. H 2SO3��SO32�� G. H2CO3��HSO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������Һ�п��ܺ��У�Na+��Mg2+��Fe2+��Cu2+��I����CO32����SO42����Cl���еļ��֣�������Ũ�Ⱦ�Ϊ0.1 mol��L��1���ֽ�������ʵ��(�����Լ�������)��
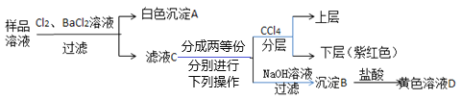
����˵����ȷ����( )
A.��Ʒ��Һ�п϶�����Na+��Fe2+��I��SO42
B.����B�п϶����������������ܺ���������þ
C.ȡ1 L��ɫ��ҺD��ǡ���ܽ���1.4 g
D.����Ʒ��Һ���Ƿ����Cl����ȡ��ҺC���μ���������ϡ�������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ع�������ָ�����в����ġ����˼���ʳ�õ���֬���ع��;��ѽ���ϴ�ӡ���ɫ��Ԥ�����������Ʊ�֬������(RCOONa)��������Σ����ͬʱ���������ڴ�����Cu2+�ķ�ˮ��
��֪��2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)�����û���̿�Եع��ͽ�����ɫ�������������˻���̿��____________�ԡ�
(2)ȡ30 mL������������ڲ�ͬ������ˮ�⣬ʵ�������±���ʾ��
��� | �Լ� | �¶� | ʱ�� | ˮ���� |
a | 20 mL3 mol/L H2SO4 | 95�� | 3Сʱ | 52.1% |
b | 20 mL 6 mol/LNaOH | 70�� | 1.5 | 97.7% |
��ʵ��a�У������������ˮ��IJ�����____________(����������)��
�ڶԱ�ʵ��a��b���Եõ��Ľ�����____________(д��2��)��
(3)��Ԥ������ĵع���ˮ�⣬��ˮ������Һ��ȥ��Cu2+��ʵ���������ͼ��ʾ��

��RCOONa����____________(�������ӻ��������������ۻ�������)��
��ʵ������������ữ��Һ���pH��Ӱ��Cu2+��ȥ���ʡ�ʵ���ã�pH=5ʱCu2+��ȥ���ʵ���pH=7ʱ�ģ���ԭ��Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com