
����Ŀ��ij����������Һ�п��ܺ��У�Na+��Mg2+��Fe2+��Cu2+��I����CO32����SO42����Cl���еļ��֣�������Ũ�Ⱦ�Ϊ0.1 mol��L��1���ֽ�������ʵ��(�����Լ�������)��
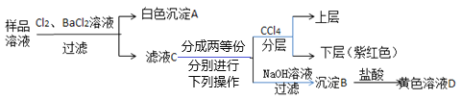
����˵����ȷ����( )
A.��Ʒ��Һ�п϶�����Na+��Fe2+��I��SO42
B.����B�п϶����������������ܺ���������þ
C.ȡ1 L��ɫ��ҺD��ǡ���ܽ���1.4 g
D.����Ʒ��Һ���Ƿ����Cl����ȡ��ҺC���μ���������ϡ�������ȷ��
���𰸡�B
��������
�������²㣨�Ϻ�ɫ����������ɫ��Һ���������Ƴ�ԭ��Һ�к���I-��Fe2+��һ��û��Cu2+������Ʒ��Һ�м���Cl2��BaCl2��Һ���õ���ɫ����������Һ�к���SO42-��CO32-���ܺ� Fe2+���棬����ȥ�������ڸ�����Ũ�Ⱦ�Ϊ0.1mol��L-1�����ݵ�����ԭ���������Ƴ���Һ��һ��������һ�������ӣ�����Mg2+���ų������Կ����Ƴ���Һ�к���Na+��Fe2+��I-��SO42-������Mg2+��Fe2+��I-��SO42-��Cl-��
A������������Ʒ�п϶�����Fe2+��I-��SO42-�����ܴ���Na+������Mg2+��Cl-��A����
B������δ�ἰ����B����Ϣ���ʸ�������ɫ��Һ�����Ƴ�����B�п϶����������������ܺ���������þ����ΪMg2+����ɫ����Ӱ��Fe3+��ɫ����ʾ����B��ȷ��
C����Ʒ��Һ�У�n(Fe2+)=0.1mol��L-1������ҺD�У�n(Fe3+)=0.1mol��L-1�����ݷ�ӦFe+2Fe3+=3Fe2+�����Ƴ�1L��ҺD�У�����Fe3+ 0.1mol�����ܽ�Fe 0.05mol����2.8g��C����
D����Ʒ��Һ��Cl2��BaCl2��Һ��Ӧ���ٹ��˵õ���ҺC������ҺCһ������Cl-���ʼ��鵽��ҺC�е�Cl-����˵����Ʒ��Һ����Cl-��D����
��ѡB��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���״����ͽ�����࣬����Ӧ����____________
���� �ڻ�����ۺ�����ܵ���ʢ��ܵ���Ĵ������Ԫ������
A.�٢ۢܢݢ� B.�٢ڢۢܢ� C.�٢ڢۢݢޢ�D.�ڢۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(HNO2)��һ�ֲ��ȶ����ᣬ�ֽ�ΪNO2��NO����������������һ����Ҫ�Ļ���ԭ�ϣ����������������������ӵȻ�ԭ�����ʣ�������Ư����ýȾ�����ش��������⣺
(1)�������ƻ��������е�Ѫ�쵰�����ã�������������Ϊ���������Ӷ�ʹѪ�쵰��ɥʧ���������Ĺ��ܶ�ʹ�����ж���һ���������������ж�������ע��������Һ�������ƣ��ƶ�������Һ����________(���������ԭ��)�ԡ�
(2)����������ۼ���ʳ�Σ���ʳ��һ������ζ����ҵ�ϳ����������ַ�������ʳ�����Ƿ�����������ơ�
��ȡ��Ʒ����ϡ���ᣬ���۲쵽________(������)��˵����Ʒ�к����������ơ�
��ȡ��Ʒ����________��Һ(���Լ�����)���ữ����Һ������˵����Ʒ�к����������ơ�
(3)�о���ͬ�����±����ܲ��������������ƺ�����ʱ��仯��ͼ��ʾ����Ҫ��֤���������ƺ�������1mg��kg-1ʱʳ�ã������������±���ʱ���ɳ����̵�˳����________(�����)��
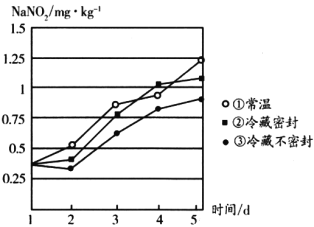
(4)��������������Ũ�ȹ��ߣ��㲻��ʳ��������������������������(ClO2)�����������ƣ�ClO2����ԭΪCl-����Ӧ�����ӷ���ʽΪ________________________������3mol ClO2���뷴Ӧ����ת�Ƶ��ӵ����ʵ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3OH����Ҫ�Ļ���ԭ��,��ҵ����CO��H2�ڴ��������ºϳ�CH3OH,�䷴ӦΪ:CO��g��+2H2��g��CH3OH��g������n(CO):n(H2)=1:2�����ܱ������г��뷴Ӧ��,���ƽ��ʱ�������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ������˵����,��ȷ����
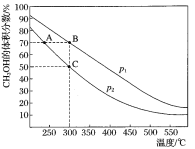
A. p1<p2
B. �÷�Ӧ�Ħ�H>0
C. ƽ�ⳣ��:K(A)=K(B)
D. ��C��ʱ,COת����Ϊ75%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Na2CO3��NaHCO3��ɵĻ��������ˮ���50 mL��Һ����μ���0.05 mol��L��1���ᣬ�õ����ɷ����ʵ����仯��ͼ��ʾ(��֪1 mol=1000 mmol)������˵������ȷ����( )
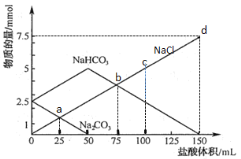
A.a����Һ��Na2CO3��NaCl���ʵ������
B.b����Һ�з�����Ӧ�Ļ�ѧ����ʽΪ��NaHCO3 + HCl = NaCl+H2O+CO2��
C.c����Һ���Ȼ��Ƶ����ʵ���Ũ��Ϊ0.05 mol��L��1
D.������ӵ�150 mLʱ���������Ʒǡ����ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����㻯����F���л���������Ҫԭ�ϣ�Ҳ���ƶ����ܹ��������ơ�
��֪����������������ʱ���������ȡ�����������������ڶ�λ�ϣ����������Ȼ�ʱ���������ȡ���������Ȼ��ļ�λ�ϡ�
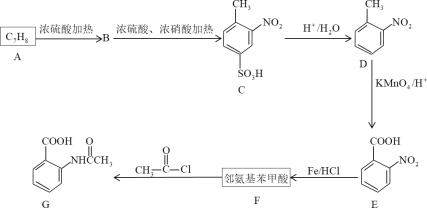
��1��D���ʵ�����Ϊ___��G�й����ŵ�����Ϊ___��___��
��2��A��F�Ľṹ��ʽ�ֱ�Ϊ___��___��E����F�ķ�Ӧ������___��
��3��д��A��B�����϶�ĸ�����Ľṹ��ʽ___��������δ���üױ�ֱ�������ķ�����ȡD�����Ǿ���������Ӧ���Ƶ�D��Ŀ����___��
��4��F��һ���������ܷ����ۺϷ�Ӧ����д���仯ѧ��Ӧ����ʽ___��
��5��F��ͬ���칹���У�����ֱ�����ڱ����ϡ����ܷ���������Ӧ�ķ����廯���ﹲ��___�֣���������ṹ����
��6�����Լױ�Ϊԭ�ϣ�д���ϳɼ䰱�������������ͼ___�����Լ���ѡ�����ϳ�����ͼ��ʾ����ʾ����CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
��1����1.0molCH4��2.0molH2O��g��ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����Ӧ��CH4��g��+H2O��g��![]() CO��g��+3H2��g����CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
CO��g��+3H2��g����CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
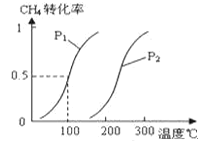
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ______��
���������������������������¶ȣ���ѧƽ�ⳣ����_______����������������С����������������
��ͼ�е�P1_____P2����������������������=������100��ʱƽ�ⳣ��Ϊ________��
�ܱ��ַ�Ӧ��ϵΪ100�棬5min�����������г���H2O��H2��0.5mol����ѧƽ�⽫��_____�ƶ���������������������������������
��2����ѹǿΪ0.1MPa�����£���amolCO��3amol H2�Ļ�������ڴ������������Է�������Ӧ��
CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
�ٸ÷�Ӧ�ġ�H_____0����S_____0����������������������=������
���������ݻ����䣬���д�ʩ�������COת���ʵ���______��
A�������¶�
B����CH3OH��g������ϵ�з������
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1molCO��3molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ���������ֵ�����е�˵���У���ȷ���ǣ� ��
A. 4.6g��������ԭ����ȫ��ΪNa+ ����ʱ��ʧȥ�ĵ�����Ϊ0.1NA
B. NA ������������NA ���������ӵ�������Ϊ8�U1
C. 0.2 NA�����������19.6g���ᣨ��Է���������98��������ͬ����ԭ����
D. 22.4L�ĵ��������е�ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ�� X2(g)+Y 2(g) ![]() 2Z(g) ����֪ X 2��Y2��Z ����ʼŨ�ȷֱ�Ϊ0.1mol/L ��0.3mol/L ��0.2mol/L ����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п����� ( )
2Z(g) ����֪ X 2��Y2��Z ����ʼŨ�ȷֱ�Ϊ0.1mol/L ��0.3mol/L ��0.2mol/L ����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п����� ( )
A.Z Ϊ 0.3mol/LB.Y2 Ϊ 0.4mol/LC.X2 Ϊ 0.2mol/LD.Z Ϊ 0.4mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com