
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入0.05 mol·L-1盐酸,得到各成分物质的量变化如图所示(已知1 mol=1000 mmol),下列说法不正确的是( )
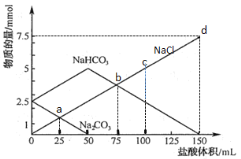
A.a点溶液中Na2CO3与NaCl物质的量相等
B.b点溶液中发生反应的化学方程式为:NaHCO3 + HCl = NaCl+H2O+CO2↑
C.c点溶液中氯化钠的物质的量浓度为0.05 mol·L-1
D.当盐酸加到150 mL时,混合物样品恰好完全反应
【答案】C
【解析】
Na2CO3和HCl的反应分为两步:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;有关量的计算,结合图中的数据去分析计算即可。
A、观察图中信息,Na2CO3的曲线降为0,而NaCl的曲线从0开始,故两条曲线的交点a点表示溶液中Na2CO3与NaCl物质的量相等,A正确;
B、b点时,NaHCO3曲线呈下降的状态,则NaHCO3被消耗,故发生NaHCO3和HCl的反应,B正确;
C、加入50mL盐酸时,Na2CO3的物质的量由2.5mmol降为0,根据反应Na2CO3+HCl=NaHCO3+NaCl 可知50mL盐酸中含有2.5mmol HCl,即c(HCl)=![]() =50mmol·L-1;c点时,NaHCO3和HCl的反应还不完全,则根据氯元素守恒,可得n(NaCl)=n(HCl)100mL=50mmol·L-1×0.1L=5mmol,则n(NaCl)=
=50mmol·L-1;c点时,NaHCO3和HCl的反应还不完全,则根据氯元素守恒,可得n(NaCl)=n(HCl)100mL=50mmol·L-1×0.1L=5mmol,则n(NaCl)=![]() =0.033mol·L-1,C错误;
=0.033mol·L-1,C错误;
D、由图知,开始时,Na2CO3、NaHCO3的物质的量为2.5mmol,完全反应需要7.5mmol HCl,c(HCl)=50mmol·L-1,则V(HCl)=![]() =0.15L=150mL,D正确;
=0.15L=150mL,D正确;
故选C。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一定量![]() 通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
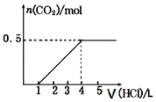
A.通入的![]() 气体为
气体为![]() L
L
B.A溶液中既含有NaOH,又含有Na2CO3
C.A溶液中n(NaHCO3) =2 n(Na2CO3)
D.盐酸浓度为2/3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10.00mL0.1000mol·L-1H2SO4溶液中滴加相同物质的量浓度的氨水,测得混合溶液中-lgc(OH-)随滴加氨水体积的变化如图所示,下列说法错误的是
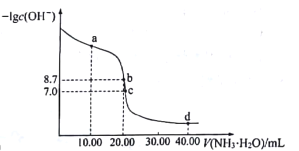
A.水的电离程度:b>c>a
B.Kh(NH4+)的数量级为10-10
C.c点满足c(SO42-)>c(NH4+)>c(H+)=c(OH-)
D.d点满足c(NH4+)+2c(H+)=c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
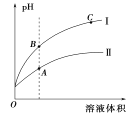
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1 mol·L-1。现进行如下实验(所加试剂均过量):
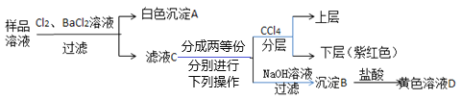
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、I、SO42
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1 L黄色溶液D能恰好溶解铁1.4 g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
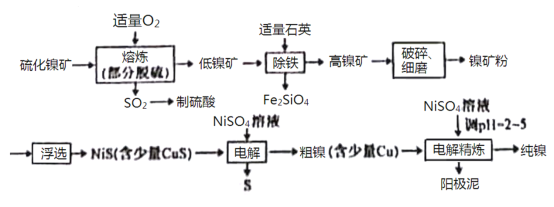
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com