
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
【答案】A
【解析】
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(g)+Y2(g)2Z(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(g)+Y2(g)2Z(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,选项A正确、选项BCD错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1 mol·L-1。现进行如下实验(所加试剂均过量):
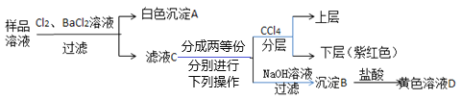
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、I、SO42
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1 L黄色溶液D能恰好溶解铁1.4 g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的____________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是____________(填物质名称)。
②对比实验a、b可以得到的结论有____________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于____________(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
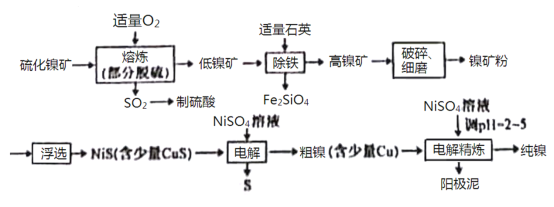
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
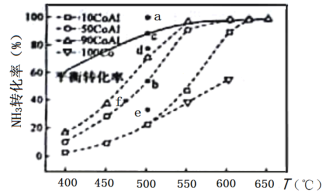
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中![]() =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际社会高度赞扬中国在应对新冠肺炎疫情时所采取的措施。疫情防控中要对环境进行彻底消毒,二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的是( )
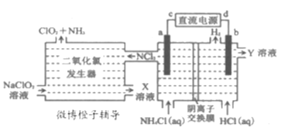
A.c为电源的负极,在b极区流出的Y溶液是浓盐酸
B.电解池a极上发生的电极反应为NH4+-6e-+3Cl-=NCl3+4H+
C.二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为6:1
D.当有0.3mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12LNH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com