
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
【答案】D
【解析】
A项、NaHS是强碱弱酸盐,HS—在溶液中水解使溶液呈碱性,水解的离子方程式为HS-+ H2O![]() H2S+ OH,故A错误;
H2S+ OH,故A错误;
B项、NaHCO3在水溶液中电离出碳酸根离子和氢氧根离子,电离方程式为HCO3+ H2O![]() CO32-+ H+,故B错误;
CO32-+ H+,故B错误;
C项、NH4Cl是强酸弱碱盐,铵根离子在溶液中水解导使溶液呈酸性,水解的离子方程式为NH4+ + H2O ![]() NH3·H2O + H+,故C错误;
NH3·H2O + H+,故C错误;
D项、硫酸铝是强酸弱碱盐,碳酸氢钠是强碱弱酸酸式盐,铝离子和碳酸氢根离子在溶液中发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑,故D正确;
故选D。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
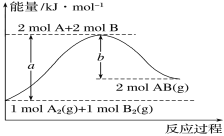
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正确操作是___(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是____。
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=____( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol氦气中有2NA个氦原子
B. 2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
C. 14 g氮气中含NA个氮原子
D. 18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室还可以利用高锰酸钾制氯气,其原理为:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,若有15.8g KMnO4做氧化剂,试计算参加反应盐酸的物质的量和被氧化的盐酸的质量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数,取17.2gTiO2样品在一定条件下溶解并还原为Ti3+,将溶液加水稀释配成250mL溶液;取出25.00mL该溶液于锥形瓶中,滴加KSCN溶液作指示剂,用0.5mol/L的NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________B的正确读数为________。
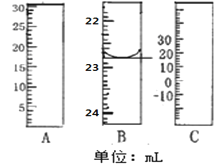
(2)TiCl4水解生成TiO2xH2O的化学方程式为________。
(3)判断滴定终点的现象是_____________。
(4)滴定到达终点时,共用去0.5mol/L的NH4Fe(SO4)2标准溶液40.00mL,则原样品中TiO2质量分数______________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能( )
A. H2SO4 B. NaOH C. AgNO3 D. Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com