
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
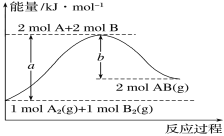
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
科目:高中化学 来源: 题型:
【题目】Ⅰ.为探究硫酸铜晶体(CuSO4·xH2O)受热分解后所得产物,设计实验装置如图所示,部分实验现象为:A中蓝色晶体逐渐变成白色粉末,继续加热最终变成黑色;B中产生白色沉淀;D中溶液变成红色。(洗气瓶中试剂均足量)

(1)分析推测该硫酸铜晶体最终分解产物可能有_______________________________。
(2)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
II.测定硫酸铜晶体(CuSO4·xH2O)中结晶水x的值,实验装置和过程如下:取硫酸铜晶体7.23 g置于硬质试管中,先通N2排除体系内空气,酒精喷灯高温加热充分,待A中蓝色晶体最终变成黑色,停止加热,再次鼓入N2至装置冷却到室温。(洗气瓶中试剂均足量)
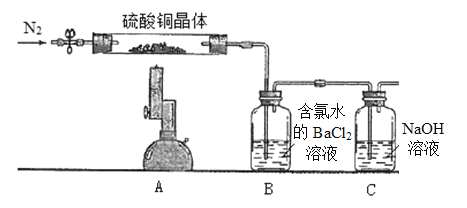
(1)取B中白色沉淀经过滤洗涤干燥称量得固体6.99 g,经计算可得CuSO4·xH2O中x=__________,再次鼓入N2的目的是____________________。
(2)某同学提出,要测定晶体中结晶水x的值,也可将B装置用装有浓硫酸的洗气瓶替换,最终测浓硫酸增重即可计算得到结果,评价该同学的方案是否可行?(如果不可行,请说明理由)_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
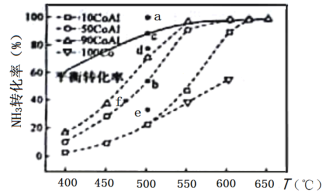
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中![]() =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____(填“向左移动”或“向右移动”),溶液颜色将___。
(2)现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___反应方向移动,正反应为____(填“吸热”或“放热”)反应,平衡时B、C的浓度之比![]() 将____。(填“增大”“减小”或“不变”,下同)。
将____。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___反应方向移动, A的质量分数___,且m+n__p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____,A的转化率____。
④若加入催化剂,平衡时气体混合物的总物质的量____。
⑤恒温恒容时,通入氦气,A的质量分数____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。
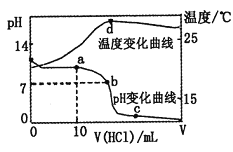
下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式___________________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-):c(ClO3-):c(Cl-)=2:1:7,则a=_________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式_____________________________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3_____KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请补上空白处:
2KClO3+2MnO2 ![]() 2KMnO4+Cl2↑+O2↑,2KMnO4
2KMnO4+Cl2↑+O2↑,2KMnO4 ![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4 + Cl2=O2↑+______________+_______________。
反应结束后将固体混合物分离开的主要操作是________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质___________________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为_____________________。
(4)有同学计划用2L的食盐水将AgCl固体中所含有的1molAg2CO3转化为AgCl,列式求出此转化的平衡常数__________________________(已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2CO3)=8.4×10-12)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com