
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式___________________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-):c(ClO3-):c(Cl-)=2:1:7,则a=_________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式_____________________________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3_____KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请补上空白处:
2KClO3+2MnO2 ![]() 2KMnO4+Cl2↑+O2↑,2KMnO4
2KMnO4+Cl2↑+O2↑,2KMnO4 ![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4 + Cl2=O2↑+______________+_______________。
反应结束后将固体混合物分离开的主要操作是________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质___________________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为_____________________。
(4)有同学计划用2L的食盐水将AgCl固体中所含有的1molAg2CO3转化为AgCl,列式求出此转化的平衡常数__________________________(已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2CO3)=8.4×10-12)。
【答案】4Cl2+H2S+4H2O=10H++SO42-+8Cl- 100 NaCl+3H2O![]() NaClO3+3H2↑ > 2KCl MnO2 溶解、过滤、洗涤、蒸发结晶 漂白性或强氧化性等 c(Na+)>c(ClO-)>c(OH-)>c(H+) 2.6×108
NaClO3+3H2↑ > 2KCl MnO2 溶解、过滤、洗涤、蒸发结晶 漂白性或强氧化性等 c(Na+)>c(ClO-)>c(OH-)>c(H+) 2.6×108
【解析】
(1)①由实验现象知H2S被氯气氧化为SO42-,由此可写出相应的离子方程式:4Cl2+H2S+4H2O=10H++SO42-+8Cl-;
②由于Cl2与KOH溶液反应后生成了三种盐KCl、KClO3、KClO,故n(K+)=2n(Cl2)=0.2mol,因此a=100mL。
(2)①由流程图知,电解NaCl溶液时得到NaClO3溶液,氯元素的化合价升高,阴极上是氢离子得到电子转化为氢气,相应的电解方程式为NaCl+3H2O![]() NaClO3+3H2↑。
NaClO3+3H2↑。
②由于钠盐、钾盐均可溶于水,向NaClO3溶液中加入KCl后得到KClO3,由此可知KClO3的溶解度比NaClO3的溶解度小。
③由于MnO2是催化剂,最终产物是KCl与氧气,故第三步应该有KCl、MnO2生成,由此可确定第三步的化学方程式。混合物中的KCl易溶于水而MnO2不溶于水,故可采用先溶解、再过滤并洗涤固体MnO2,然后蒸发除去水得到KCl固体的方法将二者分离开。
(3)由题目所给出的信息知Cl2O可以与水反应生成HClO,与NaOH溶液反应生成NaClO,HClO溶液具有强氧化性、漂白性;NaClO是强碱弱酸盐,由此可确定离子浓度的相对大小为c(Na+)>c(ClO-)>c(OH-)>c(H+)。
(4)Ag2CO3+2Cl![]() 2AgCl+CO32-,K=
2AgCl+CO32-,K=![]() =
=![]() =
=![]() =2.6×108
=2.6×108


科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
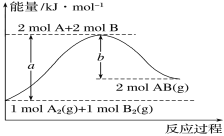
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数,取17.2gTiO2样品在一定条件下溶解并还原为Ti3+,将溶液加水稀释配成250mL溶液;取出25.00mL该溶液于锥形瓶中,滴加KSCN溶液作指示剂,用0.5mol/L的NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________B的正确读数为________。
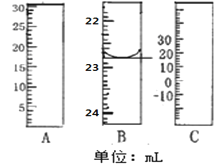
(2)TiCl4水解生成TiO2xH2O的化学方程式为________。
(3)判断滴定终点的现象是_____________。
(4)滴定到达终点时,共用去0.5mol/L的NH4Fe(SO4)2标准溶液40.00mL,则原样品中TiO2质量分数______________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )

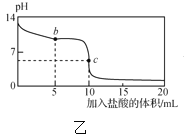
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数,取17.2gTiO2样品在一定条件下溶解并还原为Ti3+,将溶液加水稀释配成250mL溶液;取出25.00mL该溶液于锥形瓶中,滴加KSCN溶液作指示剂,用0.5mol/L的NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________B的正确读数为________。
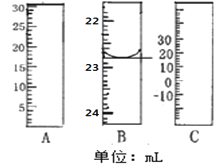
(2)TiCl4水解生成TiO2xH2O的化学方程式为________。
(3)判断滴定终点的现象是_____________。
(4)滴定到达终点时,共用去0.5mol/L的NH4Fe(SO4)2标准溶液40.00mL,则原样品中TiO2质量分数______________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能( )
A. H2SO4 B. NaOH C. AgNO3 D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com