
【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。
【答案】吸热 ![]() K1×K2 < 较低 BC >
K1×K2 < 较低 BC >
【解析】
(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,反应③的平衡常数表达式为 K=![]()
故答案为:吸热;![]() ;
;
(2)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0;分析反应特征可知反应①+②可得反应③,则平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500C时,K3=K1×K2=2.5×1.0=2.5,800C时,K3=K1×K2=2.52×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应③是放热反应,焓变△H<0,利用复合判据△G=△H-T△S < 0反应自发进行,所以反应③在只有在低温下能自发进行,
故答案为:K1×K2;<;较低;
(3)A.缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故A错误;
B.扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故B正确;
C.由于K3=K1×K2,由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故C正确;
D.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故D错误;
E.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故E错误;
故选BC;
(4)500℃时K3=K1×K2=2.5,浓度商Qc=![]() =1.4<K=2.5,反应向正反应进行,故v(正)>v(逆),
=1.4<K=2.5,反应向正反应进行,故v(正)>v(逆),
故答案为:>。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式___________________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-):c(ClO3-):c(Cl-)=2:1:7,则a=_________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式_____________________________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3_____KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请补上空白处:
2KClO3+2MnO2 ![]() 2KMnO4+Cl2↑+O2↑,2KMnO4
2KMnO4+Cl2↑+O2↑,2KMnO4 ![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4 + Cl2=O2↑+______________+_______________。
反应结束后将固体混合物分离开的主要操作是________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质___________________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为_____________________。
(4)有同学计划用2L的食盐水将AgCl固体中所含有的1molAg2CO3转化为AgCl,列式求出此转化的平衡常数__________________________(已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2CO3)=8.4×10-12)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出BC段反应的离子方程式为____________________________。
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:1
C.等物质的量的NaHCO3和Na2CO3分别与足量盐酸反应,同温同压下,生成的CO2体积不相同
D.分别向NaHCO3溶液和Na2CO3溶液中加入Ca(OH)2溶液,只有Na2CO3溶液产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
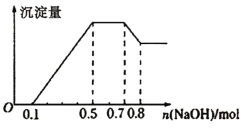
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32-和SO42-,可能含有Cl-
C.溶液中n(Mg2+)=0.1mol
D.n(H+) :n(NH4+) : n(Al3+) : n(Mg2+)=2:4:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~N存在如图转化关系,其中气体D、E为单质,试回答:
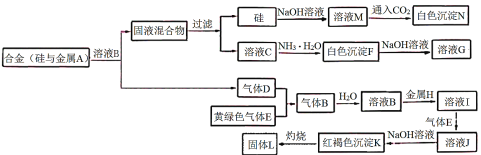
(1)写出下列物质的化学式:
气体B是___,沉淀N是___。
(2)写出反应“C→F”的离子方程式:___。
(3)写出反应“I→J”的离子方程式:___。
(4)在溶液I中直接滴加NaOH溶液,放置中可观察到的现象是___,后期发生变化的原因可用化学方程式解释为___。
(5)固体L是一种红色颜料,将一定量固体L溶于160mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
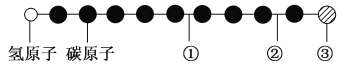
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com