
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出BC段反应的离子方程式为____________________________。
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a=______。
【答案】Al(OH)3+OH-=AlO2-+2H2O 5.1g 6mol/L 5mol/L 20
【解析】
根据图像可知,oa段为过量的盐酸与NaOH反应,AB段为镁离子、铝离子与NaOH的反应,BC段为氢氧化铝与NaOH的反应。
(1) BC段为氢氧化铝与NaOH的反应,生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(2) BC段减少的为氢氧化铝沉淀,质量为7.8g,物质的量为0.1mol,即n(Al)=0.1mol;则氢氧化镁的质量为5.8g,物质的量为0.1mol即n(Mg)=0.1mol;合金的质量为24×0.1+27×0.1=5.1g;
(3)根据方程Al(OH)3+OH-=AlO2-+2H2O,消耗20mL的NaOH时的物质的量为0.1mol,则c(NaOH)=0.1mol÷0.02L=5mol/L;B点时,溶液刚好为NaCl溶液,此时消耗n(NaOH)=5×0.12=0.6mol,c(HCl)=0.6÷0.1=6mol/L;
(4)由(3)得出的结论,c(NaOH)=5mol/L;
(5) n(Mg)=n(Al)=0.1mol,消耗的盐酸为0.5mol,100mL溶液中含有n(HCl)=0.6mol,则剩余n(HCl)=0.1mol,此时消耗V(NaOH)=0.1÷5=0.02L,即20mL。


科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )

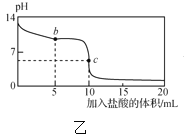
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓦斯分析仪(如图甲)工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述中正确的是( )
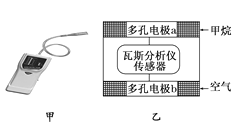
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2-―8e-===CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的无机化合物,可形成CuSO4 .5H2O、CuSO4 .H2O等多种结 晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。冋答下列问题:
(1)CuSO4 .5H2O的俗名是________ 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯 制备“电镀硫酸铜”(CuSO4 .H2O)的生产流程如下:

溶解所用的酸最适宜的是_____ ,氧化的产物中有比H3AsO4和______,调节pH时生成固体的主要成分除FeAsO4、Fe((OH)) 3外还有______,生成FeAsO4反应的离子方程是________,操作a需经过蒸发浓缩、____、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是______________________。

(3)用CuSO4溶液电解精炼铜的装置如图所示,粗铜中含 锌、银、铂杂质,阳极发生的电极反应式_______: 目前世界正在 大力开展用Cu+的络合物作电解质溶液制备纯铜的研究,电解Cu+的 络合物与电解CuSO4溶液相比较,优点是________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1molFe3O4,转移电子的物质的量为2mol
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )
A. KClO3在反应中失去电子B. ClO2是还原产物
C. H2C2O4在反应中被还原D. 1 mol H2C2O4参加反应有4 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com