
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )

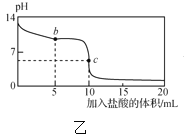
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】B
【解析】
A项、由图甲可知,a点c(HCN)= c(CN-),溶液中c(H+)=10-9.5,则HCN的电离平衡常数Ka(HCN)=![]() = c(H+)=10-9.5,故A错误;
= c(H+)=10-9.5,故A错误;
B项、由物料守恒可知NaCN溶液和反应后的溶液中均存在c(Na+)=c(HCN)+c(CN-),由电荷守恒关系可知溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),pH=7的溶液中c(OH-)=c(H+),则三式合并可得c(Cl-)=c(HCN),故B正确;
C项、向10mL0.01moL/LNaCN溶液滴加入5mL0.01moL/L的盐酸,两者反应得到物质的量浓度相等的HCN、NaCN和NaCl混合液,溶液呈碱性说明NaCN的水解为大于HCN的电离,则c(HCN)> c(CN-),故C错误;
D项、图乙中c点10mL0.01moL/LNaCN溶液与10mL0.01moL/L的盐酸恰好完全反应生成氯化钠和氢氰酸混合液,由物料守恒可知,溶液中存在c(Cl-)=c(Na+)=c(HCN)+c(CN-),由电荷守恒可知,溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则两式合并可得c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。
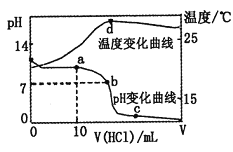
下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四有机物存在如图所示的转化关系,有关说法错误的是( )

A.有机物①最多有9个原子共平面
B.有机物②可以发生取代反应、加成反应和加聚反应
C.有机物③和有机物④互为同分异构体
D.有机物①②③④都能使酸性KMnO4溶液褪色,都有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际社会高度赞扬中国在应对新冠肺炎疫情时所采取的措施。疫情防控中要对环境进行彻底消毒,二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的是( )
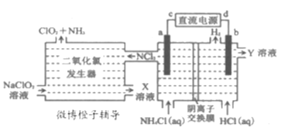
A.c为电源的负极,在b极区流出的Y溶液是浓盐酸
B.电解池a极上发生的电极反应为NH4+-6e-+3Cl-=NCl3+4H+
C.二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为6:1
D.当有0.3mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12LNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡胶行业是国民经济的重要基础产业之一,在现代生产、军事工业、医疗行业中有广泛应用。如图是生产合成橡胶G和医用高分子材料C的路线图,已知B的分子式为C6H10O3。请回答下列问题:
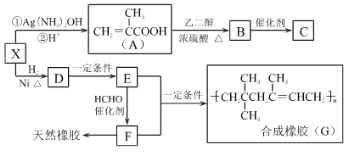
(1)X中的含氧官能团名称是___,X的核磁共振氢谱有___组峰。
(2)A→B的反应类型是___。
(3)C的结构简式是___。
(4)X发生银镜反应的化学方程式为___。
(5)写出E→F的化学反应方程式___。
(6)A有多种同分异构体,其中属于酯类且含有碳碳双键的共有___种(不含立体异构)。
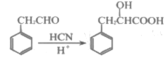
(7)已知:①![]() ②
②![]() +SOCl2→
+SOCl2→![]() +SO2+HCl。请将下列以
+SO2+HCl。请将下列以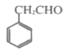 为原料制备
为原料制备 的合成路线流程图补充完整___(无机试剂任用)。
的合成路线流程图补充完整___(无机试剂任用)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式___________________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-):c(ClO3-):c(Cl-)=2:1:7,则a=_________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式_____________________________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3_____KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请补上空白处:
2KClO3+2MnO2 ![]() 2KMnO4+Cl2↑+O2↑,2KMnO4
2KMnO4+Cl2↑+O2↑,2KMnO4 ![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4 + Cl2=O2↑+______________+_______________。
反应结束后将固体混合物分离开的主要操作是________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质___________________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为_____________________。
(4)有同学计划用2L的食盐水将AgCl固体中所含有的1molAg2CO3转化为AgCl,列式求出此转化的平衡常数__________________________(已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2CO3)=8.4×10-12)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出BC段反应的离子方程式为____________________________。
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com