
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )
A. KClO3在反应中失去电子B. ClO2是还原产物
C. H2C2O4在反应中被还原D. 1 mol H2C2O4参加反应有4 mol电子转移
【答案】B
【解析】
2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,其余元素的化合价不变,据此分析解答。
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,其余元素的化合价不变,据此分析解答。
A.KClO3中Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故A错误;
B.KClO3中Cl元素的化合价由+5价降低为+4价,所以氯酸钾为氧化剂,其对应的产物ClO2是还原产物,故B正确;
C.H2C2O4中C元素的化合价由+3价升高到+4价,H2C2O4为还原剂,在反应中被氧化,故C错误;
D.1mol H2C2O4参加反应有1mol×(4-3)=1mol电子转移,故D错误;
答案选B。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O32-+2H+=SO2↑+S↓+H2O
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3=2FeO42-+3Cl+4H++H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO3-+OH=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
A.0.1molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.观察Fe(OH)2的生成
B.配制一定物质的量浓度的NaCO3溶液
C.除去CO中的CO2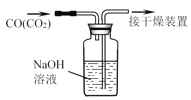
D.实验室模拟制备NaHCO3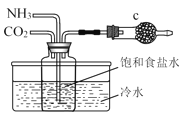
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
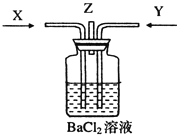
A. 洗气瓶中产生的沉淀中有碳酸钡 B. 在Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡 D. 洗气瓶中无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。

已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1) 反应①的化学方程式为______________________________________,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有___,不采用瓷坩埚而选用铁坩埚的理由是______________
(2) 反应②中氧化产物与还原产物的物质的量之比为___________________;上述流程中可以循环利用的物质是__________________________。
(3) 实验时,从滤液中得到KMnO4晶体的实验操作a为___________________,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
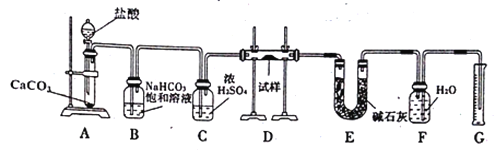
回答下列问题:
(1)实验前必须先_______________________________________________。
(2)装置B的作用是_____________;装置E的作用是______________;
(3)装置D中发生氧化还原反应的化学方程式是:__________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
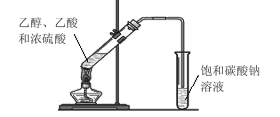
①试管中加入乙醇、乙酸和浓硫酸的顺序是_______;
②浓硫酸的作用是_________;
③饱和碳酸钠溶液的主要作用____;
④装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是________。
⑤若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
⑥进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是______。
⑦生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号)______。
A 单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B 单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C 单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D 正反应的速率与逆反应的速率相等
E 混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com