
【题目】某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
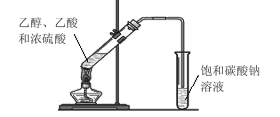
①试管中加入乙醇、乙酸和浓硫酸的顺序是_______;
②浓硫酸的作用是_________;
③饱和碳酸钠溶液的主要作用____;
④装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是________。
⑤若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
⑥进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是______。
⑦生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号)______。
A 单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B 单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C 单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D 正反应的速率与逆反应的速率相等
E 混合物中各物质的浓度不再变化
【答案】先加乙醇,再缓慢加入浓硫酸,最后加入乙酸 催化剂、吸水剂 吸收挥发出来的乙酸和乙醇,降低乙酸乙酯溶解度 防止倒吸; 导气、将反应生成的乙酸乙酯蒸气冷凝 分液 防止暴沸 BDE
【解析】
乙酸和乙醇在浓硫酸的催化作用下发生酯化反应,生成乙酸乙酯和水,方程式为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体,混合乙醇和浓硫酸的方法是先加入一定量的乙醇,然后边振荡边加入浓硫酸,浓硫酸的密度大于乙醇,防止酸液飞溅,乙酸和乙醇易溶于水,导管口在饱和碳酸钠溶液液面上,而不插入液面下是为了防止倒吸。
CH3COOCH2CH3+H2O,实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体,混合乙醇和浓硫酸的方法是先加入一定量的乙醇,然后边振荡边加入浓硫酸,浓硫酸的密度大于乙醇,防止酸液飞溅,乙酸和乙醇易溶于水,导管口在饱和碳酸钠溶液液面上,而不插入液面下是为了防止倒吸。
①浓硫酸稀释时放热,应将密度大的浓硫酸倒入乙醇中。试管中加入乙醇、乙酸和浓硫酸的顺序是:先加乙醇,再缓慢加入浓硫酸,最后加入乙酸;
②浓硫酸在反应中起到催化剂的作用,为利于反应向正反应方向移动,浓硫酸起到吸水作用,故为:催化剂、吸水剂;
③实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体,故答案为:吸收挥发出来的乙酸和乙醇,降低乙酸乙酯溶解度;
④乙酸和乙醇易溶于水,导管口在饱和碳酸钠溶液液面上,而不插入液面下是为了防止倒吸,用长导管可与空气发生充分的热交换,利于蒸汽的冷却,故答案为:防止倒吸;导气、将反应生成的乙酸乙酯蒸气冷凝;
⑤乙酸乙酯为难溶于饱和碳酸钠的液体,可用分液的方法分离,故答案为:分液;
⑥碎瓷片起到防止暴沸的作用,故答案为:防止暴沸;
⑦A.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间里,生成1mol乙酸乙酯,同时生成1mol水,故A错误;
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,达到平衡状态,故B正确;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,故C错误;
D.正反应的速率与逆反应的速率相等,说明达到平衡状态,故D正确;
E.混合物中各物质的浓度不再变化,说明达到平衡状态,故E正确。
故选BDE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )
A. KClO3在反应中失去电子B. ClO2是还原产物
C. H2C2O4在反应中被还原D. 1 mol H2C2O4参加反应有4 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
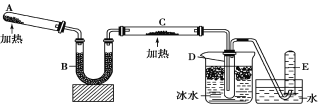
(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是______。
(2)B的作用是______。
(3)C中发生反应的化学方程式是:___,并在方程式中用单线桥标出电子转移的方向和数目___。
(4)D中收集到的物质是___,检验该物质的方法和现象是___;E中收集到的气体是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
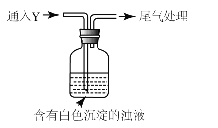
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如下反应得到
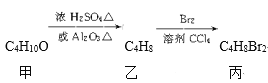
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15mL 1.0mol/L的CH3COOH(Ka=1.8×10-5)加入到5mL 2.0mol/L的NaOH溶液中,并将混合溶液稀释至100mL,则制得的溶液pH值约为
A. 4.4B. 4.8
C. 5.0D. 5.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
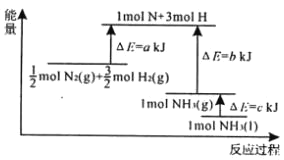
A.断裂0.5molN2(g)和1.5mol H2(g)中所有的化学键释放a kJ热量
B.NH3(g)═NH3(l)△H=c kJmol﹣1
C.N2(g)+3H2(g)2NH3(g)△H=﹣2(a﹣b)kJmol﹣1
D.2NH3(l)N2(g)+3H2(g)△H=2(b+c﹣a) kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃时,11.6g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6g,再将反应后剩余固体冷却后加入含有Na+、HCO3-、SO32-、CO32-等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是
A.原混合气体的平均摩尔质量为23.2g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol
C.溶液中SO32-的物质的量浓度基本保持不变
D.溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是HCO3-和CO32-的物质的量浓度之和基本保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com