
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正确操作是___(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是____。
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=____( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.量取NaOH溶液的体积时仰视读数
【答案】保温隔热,减少热量的散失 A 用套在温度计上的环形玻璃棒轻轻地搅动 3.4 -56.8 kJ/mol a b cd
【解析】
(1)本实验成功的关键是:保温隔热,减少热量的散失;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)硫酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使硫酸与NaOH溶液混合均匀;
(4)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=m·c·△T计算反应放出的热量,最后根据△H=-Q/nkJ·mol-1计算出反应热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱反应放热,硫酸的起始温度偏高;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,减少热量损失;
d.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小;
(1)大小烧杯中填充泡沫塑料的作用是:保温隔热,减少热量的散失;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果;
故选A。
(3)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(4)①4次温度差分别为:3.4℃,5.1,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃;
②50mL 0.25mol·L-1硫酸与50mL 0.55mol·L-1 NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol·L-1×2=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m·c·△T=100g×4.18J/(g·℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-1.4212kJ/0.025mol=-56.8kJ·mol-1;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,酸碱反应放热,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故c正确;
d.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故d正确.
故选abcd。


科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
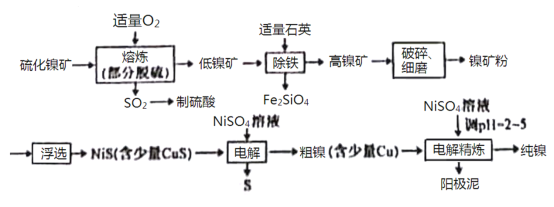
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
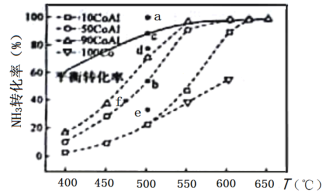
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中![]() =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:

回答下列问题:
(1)该结构基态P原子中,核外电子占据最高能层的符号是________________,占据该能层电子的电子云轮廓图形状为________________。
(2)瑞德西韦中位于第二周期元素的第一电离能从大到小的顺序为________________,分子中氮原子的杂化类型有________________。
(3)苯酚(![]() )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(![]() )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韦的催化剂之一。MgSO4中,阴离子的空间构型为________________。
(5)磷酸也是合成瑞德西韦的原料之一。直链的多磷酸盐则是-种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
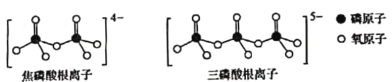
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
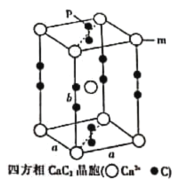
(6)合成瑞德西韦的原料之一的苯酚可通过如下途径制得:电石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化钙(CaC2)晶体的晶跑结构如图所示.其晶胞参数分别为apm、apm、bpm,四方相碳化钙晶体的密度为![]() g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是某合成农药的中间体,其结构为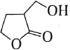 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量的二氧化锰和40mL 10mol/L浓盐酸充分反应制氯气,下列说法正确的是
A.该实验中共消耗0.1 mol MnO2,生成标准状况下2.24L氯气
B.氯气有毒、有刺激性气味,常用澄清石灰水吸收多余的氯气
C.氯气可以用向下排空气法或排水法收集
D.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.Cl2 +H2O![]() HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
B.CO2(aq)![]() CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
C.I2(g)+H2(g) ![]() 2HI(g)的平衡体系,加压后颜色变深
2HI(g)的平衡体系,加压后颜色变深
D.2NO2(g)![]() N2O4(aq)加压后颜色先变深后变浅
N2O4(aq)加压后颜色先变深后变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com