
【题目】实验室用足量的二氧化锰和40mL 10mol/L浓盐酸充分反应制氯气,下列说法正确的是
A.该实验中共消耗0.1 mol MnO2,生成标准状况下2.24L氯气
B.氯气有毒、有刺激性气味,常用澄清石灰水吸收多余的氯气
C.氯气可以用向下排空气法或排水法收集
D.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
【答案】D
【解析】
实验室用足量的二氧化锰和浓盐酸充分反应制氯气,反应方程式为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,因生成了水,导致反应中浓盐酸浓度降低,反应逐渐停止,生成的氯气为黄绿色、有毒的气体,密度比空气大,可用向上排空气法收集,反应中MnO2为氧化剂,浓盐酸为还原剂,据此分析判断。
MnCl2+Cl2↑+2H2O,因生成了水,导致反应中浓盐酸浓度降低,反应逐渐停止,生成的氯气为黄绿色、有毒的气体,密度比空气大,可用向上排空气法收集,反应中MnO2为氧化剂,浓盐酸为还原剂,据此分析判断。
A. 实验室用足量的二氧化锰和浓盐酸充分反应制氯气,反应生成了数水,导致反应中浓盐酸浓度降低,反应逐渐停止,因此消耗0.1 mol MnO2,生成标准状况下的氯气少于2.24L,A项错误;
B. 氯气有毒、有刺激性气味,常用氢氧化钠溶液吸收多余的氯气,B项错误;
C. 氯气的密度大于空气,可以用向上排空气法收集,氯气能与水反应生成盐酸和次氯酸,不能用排水法收集,C项错误;
D. 在该反应中二氧化锰作氧化剂,浓盐酸作还原剂,D项正确;
答案选D。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
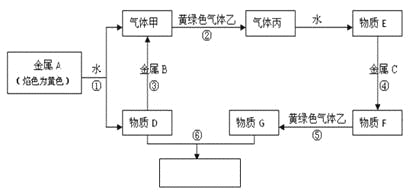
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A、______B、______C、________乙__________
(2)写出下列反应化学方程式:
反应①___________________________________
反应③___________________________________
(3)写出下列反应离子方程式:
反应④___________________________________
反应⑥___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正确操作是___(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是____。
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=____( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室还可以利用高锰酸钾制氯气,其原理为:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O,若有15.8g KMnO4做氧化剂,试计算参加反应盐酸的物质的量和被氧化的盐酸的质量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
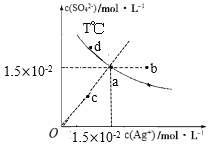
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数,取17.2gTiO2样品在一定条件下溶解并还原为Ti3+,将溶液加水稀释配成250mL溶液;取出25.00mL该溶液于锥形瓶中,滴加KSCN溶液作指示剂,用0.5mol/L的NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________B的正确读数为________。
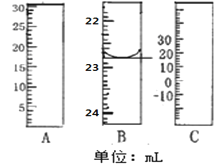
(2)TiCl4水解生成TiO2xH2O的化学方程式为________。
(3)判断滴定终点的现象是_____________。
(4)滴定到达终点时,共用去0.5mol/L的NH4Fe(SO4)2标准溶液40.00mL,则原样品中TiO2质量分数______________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氯水中含有的粒子及其性质,某化学小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是____(填粒子符号)。
(2)向氯水中滴入Na2CO3溶液,有气体生成,说明氯水中含有的粒子是___(填粒子符号)。
(3)氯水经光照后,观察到的现象是_______,溶液的酸性_____(填“增强”“不变”或“减弱”)。
(4)氯水中具有氧化性的含氯微粒有_______(填粒子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com