
【题目】已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
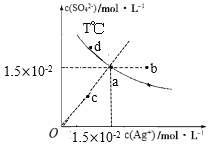
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
【答案】C
【解析】
A.a点溶液加入硝酸银固体,虽然银离子浓度增大,但温度不变溶度积不变,a点应沿实线向下移动,故A错误;
B.硫酸银溶液中存在平衡Ag2SO4![]() 2Ag++SO42-,a点c(Ag+)= c(SO42-),降低温度析出硫酸银,则c(Ag+)和 c(SO42-)不再相等,所以无法移动到c点,故B错误;
2Ag++SO42-,a点c(Ag+)= c(SO42-),降低温度析出硫酸银,则c(Ag+)和 c(SO42-)不再相等,所以无法移动到c点,故B错误;
C.向a点的悬浊液中加入NaCl固体,会生成氯化银沉淀,银离子浓度减小,硫酸银的沉淀溶解平衡右移,硫酸根离子浓度增大,但温度不变,硫酸银的溶度积不变,所以溶液组成会由a向d方向移动,故C正确;
D.根据a点,Ksp(Ag2SO4)=c2(Ag+)· c(SO42-)=(1.5×10-2)2×1.5×10-2=3.375×10-6,故D错误;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:

回答下列问题:
(1)该结构基态P原子中,核外电子占据最高能层的符号是________________,占据该能层电子的电子云轮廓图形状为________________。
(2)瑞德西韦中位于第二周期元素的第一电离能从大到小的顺序为________________,分子中氮原子的杂化类型有________________。
(3)苯酚(![]() )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(![]() )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韦的催化剂之一。MgSO4中,阴离子的空间构型为________________。
(5)磷酸也是合成瑞德西韦的原料之一。直链的多磷酸盐则是-种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
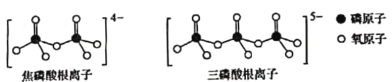
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
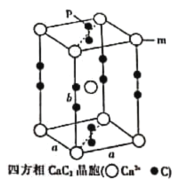
(6)合成瑞德西韦的原料之一的苯酚可通过如下途径制得:电石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化钙(CaC2)晶体的晶跑结构如图所示.其晶胞参数分别为apm、apm、bpm,四方相碳化钙晶体的密度为![]() g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是某合成农药的中间体,其结构为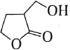 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成。(提示:铝与氧化铁发生的反应称为铝热反应)
②另取20g A全部溶于0.15L 6.0mol·L-1盐酸中,得溶液C。
③将①中得到的单质B和溶液C反应,放出气体1.12L(标准状况下),同时生成溶液D,还残留固体B。
④用KSCN溶液检验时,溶液D不变色。
(1)反应①的产物中的单质B是________,反应方程为____________。若将单质B溶于盐酸中,再向所得溶液中滴加足量的NaOH溶液后振荡,可看到的现象为___________,此过程用化学方程可以表示为______________。
(2)②所发生各反应的离子方程式是:___________________和___________________。
(3)若溶液D的体积仍为0.15L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量的二氧化锰和40mL 10mol/L浓盐酸充分反应制氯气,下列说法正确的是
A.该实验中共消耗0.1 mol MnO2,生成标准状况下2.24L氯气
B.氯气有毒、有刺激性气味,常用澄清石灰水吸收多余的氯气
C.氯气可以用向下排空气法或排水法收集
D.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是
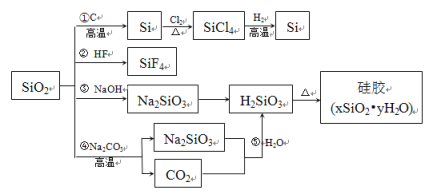
A.SiO2既能发生②反应,又能发生③反应,说明SiO2属于两性氧化物
B.④反应是水泥工业的化学反应原理之一,⑤反应可证明H2CO3酸性强于H2SiO3
C.①反应的生成物除Si外还有CO2,硅胶可用作催化剂的载体
D.除了粗硅的制备和提纯过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导和半导体材料都广泛应用于航空航天测控、光纤通讯等领域。请回答下列与碳、砷、镓、硒有关的问题。
(1)基态硒原子的核外价层电子排布式为___,与硒同周期的p区元素中第一电离能大于硒的元素有___种,SeO3的空间构型是___。
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。
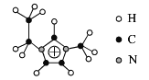
①EMIM+离子中各元素电负性由大到小的顺序是___。
②EMIM+离子中碳原子的杂化轨道类型为___。
③大π键可用符号π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
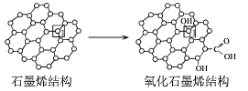
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是___。
(4)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值为NA=___。(用字母表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)
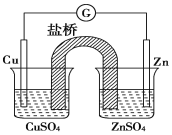
A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com