

| a | b | c | d | |
| I | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| �� | ��ʯ�� | �轺 | Ũ���� | ��ˮ�Ȼ��� |
| �� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
���� ��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ��Ũ�����ӷ�����ȡ�������к����Ȼ��⣬�Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ��ݴ�ѡ��ʳ��ˮ��ȥ�����е��Ȼ��⣬BΪ��ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�е�ѹǿ���ݴ˽��
��2����֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�
��� �⣺��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ����ѧ����ʽ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
�Ʊ��������к����Ȼ��⣬�Ȼ����ڱ���ʳ��ˮ���ܽ�Ƚϴ������ڱ���ʳ��ˮ���ܽ�Ȳ������Կ�����B�б���ʳ��ˮ���������е��Ȼ��⣻
���ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ�������彫��Һѹ�볤��©��B�У��γ�ˮ����
�ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����ȥCl2�е�HCl��B�г���©����Һ���������γ�ˮ����
��2��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����ab�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�c��IIΪ��������������ΪŨ���ᣬ����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd��
�ʴ�Ϊ��d��
���� ���⿼��������ʵ������ȡ��������ѧ���ʡ�ʵ����ơ�ʵ��װ�õ��������ۡ���ѧ����ʽ����д�ȣ��Ƕ���ѧ֪ʶ���ۺ����ã�ע�����֪ʶ�����գ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ�е�ʵ��װ����ȡ��Ȳ��
��ͼ�е�ʵ��װ����ȡ��Ȳ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��װ�ó�ȥ���������л��е��������� | |
| B�� |  ��װ�ó�ȥ�����е������Ȼ��� | |
| C�� | 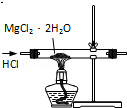 ��װ����ȡ��ˮMgCl2 | |
| D�� |  ��װ����ȡ��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

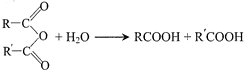
 ��G
��G

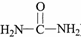 ����ԭ���ϵ���ԭ�ӿ�����A�ϵ���ԭ��������C�����ӳɷ�Ӧ�������۳ɸ߷��ӻ����д��������C��һ���������������Ը߷��ӻ�����Ļ�ѧ����ʽ
����ԭ���ϵ���ԭ�ӿ�����A�ϵ���ԭ��������C�����ӳɷ�Ӧ�������۳ɸ߷��ӻ����д��������C��һ���������������Ը߷��ӻ�����Ļ�ѧ����ʽ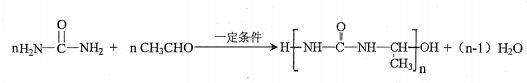
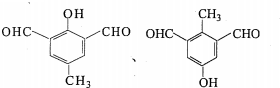 ����һ�֣�
����һ�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
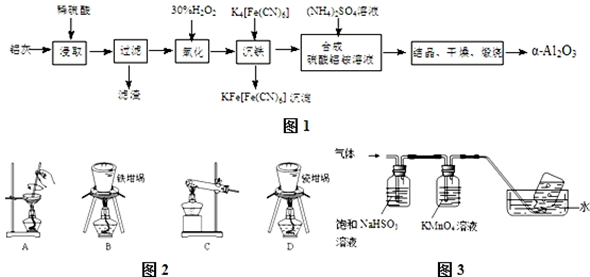
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| X | ��ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ� |
| Y | �ؿ��к����ӵ�һλ |
| Z | ����������ԭ�Ӱ뾶��� |
| Q | �����д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�� |
| M | ��ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6 |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
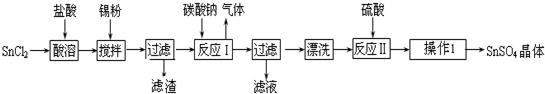
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
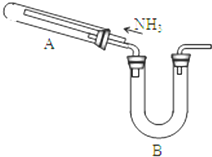 ij�о���ѧϰС���������²�����̽��NH3�Ļ�ԭ�ԣ�����ʵ��װ����ͼ��
ij�о���ѧϰС���������²�����̽��NH3�Ļ�ԭ�ԣ�����ʵ��װ����ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
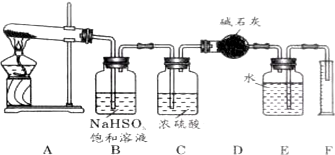
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com