
【题目】在反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:(1)反应消耗的氧化剂的质量;(2)被氧化的HCl的质量。
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:(1)反应消耗的氧化剂的质量;(2)被氧化的HCl的质量。
【答案】4.35g;3.65g
【解析】
(1)、该反应中,锰元素化合价由+4价变为+2价,氯元素化合价由-1价变为0价,所以二氧化锰是氧化剂,根据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O得MnO2~Cl2,则消耗的氧化剂的质量= 3.55g÷71g/mol×87g/mol =4.35g,故答案是:4.35g;
MnCl2+Cl2↑+2H2O得MnO2~Cl2,则消耗的氧化剂的质量= 3.55g÷71g/mol×87g/mol =4.35g,故答案是:4.35g;
(2)、被氧化的HCl生成氯气,根据氯元素守恒,可知被氧化HCl与氯气的关系是:2HCl~Cl2,则被氧化的HCl的物质的量为2×3.55g÷71g/mol=0.1mol,被氧化HCl的质量为0.1mol×36.5g/mol=3.65g,故答案是:3.65g。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).某溶液有Cl-、CO![]() 、SO
、SO![]() ,要求依次检验出这三种离子,请完成下列实验设计:
,要求依次检验出这三种离子,请完成下列实验设计:
检验离子 | 所加试剂 | 实验现象 | 离子方程式 |
①CO | 稀硝酸 | _________ | _________ |
②SO | _________ | 产生白色沉淀 | _________ |
③ Cl- | _________ | 产生白色沉淀 | _________ |
(2)KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
回答下列问题:

①试剂Ⅰ的化学式为________________,判断试剂Ⅰ已加过量的方法是_____________。
② ②中加入试剂Ⅱ的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的能源,通过石油分馏可得到重油,以重油为原料,可合成X:CH3COOCH=CH2。其中A是最简单的烯烃,B能发生银镜反应,D的相对分子质量比A小2。请回答下列有关问题:

(1)A中的官能团名称是___________________
(2)B→C的化学方程式_____________________________
(3)已知C与D发生加成反应生成X,其化学方程式为________________________
(4)下列说法正确的是_____
A.此处的“某工艺”指的是分馏 B.B在一定条件下能与氢气发生加成反应
C.X不溶于水,能使酸性高锰酸钾溶液褪色 D.可用溴的四氯化碳溶液鉴别A和D
(5)F是X的同分异构体,1molF能与4molAg(NH3)2OH反应,写出F可能的结构简式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:除去CO的化学反应方程式为:[Cu(NH3)]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题
(1)基态Fe原子的核外电子排布式为______________________;
(2)铁的一种配合物Fe(CO)x的中心原子价电子数与配体用于成键提供的电子数之和为18,则x=__________;已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CC14,据此可以判断Fe(CO)x晶体属于___________(填晶体类型)。与CO互为等电子体的分子的分子式为___________。
(3)配合物[Cu(NH3)]OOCCH3中碳原子的杂化类型是___________。用[Cu(NH3)]OOCCH3除去CO的反应中,肯定有___________形成。
a.离子键 b.配位键 c.非极性键 d.σ键
(4)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___________。铁晶体的体心立方堆积空间利用率为___________(用含π的式子表示)。
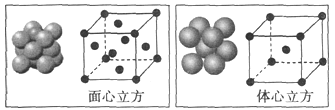
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将纯水加热至较高温度,Kw变大、pH变小、呈酸性
B. 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大
D. 等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的H2多,说明HA的酸性小于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是

A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解熔融氧化铝制取金属铝,氧化铝只被还原
B.电解熔融NaCl制取Na,在阴极得到Na
C.电解水时,在相同条件下,阳极和阴极产生的气体体积之比为2:1
D.电解食盐水制H2、Cl2的过程是把化学能转变为电能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定中和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,则中和热△H=___kJ/mol。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:(用离子方程式表示)___________。
(2)达到滴定终点时的颜色变化为___________ 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的___________读数为mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验序号 | ① | ② | ③ |
消耗KMnO4溶液体积/mL | 26.53 | 24.02 | 23.98 |
从上表可以看出,实验①中记录消耗KMnO4溶液的体积明显多于②③,其原因可能是 ______________________。
A.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
B.①滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,②③均用标准液润洗
C.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
D.①滴定用的锥形瓶用待测液润洗过,②③未润洗
(5)H2C2O4的物质的量浓度=______________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com