
| A����������������Ӧ�����Ȼ��ƺ�,��ṹ���ȶ�����ǿ,��ϵ���������� |
| B������ȼ�տɿ��ɡ����桱�������ڲ�������(��ѧ��)ת��Ϊ�����ͷų��� |
| C���������ڲ������ź�ǿ�Ĺ��ۼ�,��ͨ��״���µ�����ѧ���ʺܻ��� |
| D����Ҫ���Ȳ��ܷ����ķ�Ӧ��һ�������������ķ�Ӧ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��п��ϡ����ķ�Ӧ | B���Ȼ���������������巴Ӧ |
| C��ú��ȼ�� | D����������������ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3�������仯����ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� ��
2NH3�������仯����ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ� ��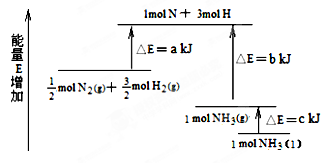
A��N2(g)��3H2(g)  2NH3(l) �SH ��2(a��b��c)kJ��mol��1 2NH3(l) �SH ��2(a��b��c)kJ��mol��1 |
B��N2(g)��3H2(g)  2NH3(g) �SH ��2(b��a)kJ��mol��1 2NH3(g) �SH ��2(b��a)kJ��mol��1 |
C��1/2N2(g)��3/2H2(g)  NH3(l)�SH �� (b��c��a)kJ��mol��1 NH3(l)�SH �� (b��c��a)kJ��mol��1 |
D��1/2N2(g)��3/2H2(g)  NH3(g)�SH �� (a��b)kJ��mol��1 NH3(g)�SH �� (a��b)kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���к���һ����ǿ���ǿ�Ӧ�ų������� |
| B��1 mol����1 mol ����ȫ��Ӧ�ų����������к��� |
| C����ϡ��Һ��,�������кͷ�Ӧ����1 mol H2O(l)ʱ�ķ�Ӧ�Ƚ����к��� |
| D���ⶨ�к���ʱ����ϡ�����ϡBa(OH)2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ȼ�����ڷ��ȷ�Ӧ | B���кͷ�Ӧ�����ȷ�Ӧ |
| C���γɻ�ѧ��ʱ�������� | D����Ӧ����������������������һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ȷ�Ӧ |
| B���Ƿ��ȷ�Ӧ |
| C������183 kJ���� |
| D���ų�183 kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��N2(g)��3H2(g) 2NH3(g)����H����93 kJ��mol��1 2NH3(g)����H����93 kJ��mol��1 |
B��N2(g)��3H2(g) 2NH3(g)����H����1471 kJ��mol��1 2NH3(g)����H����1471 kJ��mol��1 |
C��N2(g)��3H2(g) 2NH3(g)����H����93 kJ��mol��1 2NH3(g)����H����93 kJ��mol��1 |
D��N2(g)��3H2(g) 2NH3(g)����H����1471 kJ��mol��1 2NH3(g)����H����1471 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2(g)��F2(g)=2HF(g)����H����Q1 kJ��mol��1 H2(g)��Cl2(g)=2HCl(g)����H����Q2 kJ��mol��1 |
| B��2H2(g)��O2(g)=2H2O(l)����H����Q1 kJ��mol��1 2H2(g)��O2(g)=2H2O(g)����H����Q2 kJ��mol��1 |
| C��NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)��H����Q1 kJ��mol��1 NaOH(aq)��CH3COOH(aq)=CH3COONa(aq)��H2O(l)��H����Q2 kJ��mol��1 |
| D��S(s)��O2(g)=SO2(g)����H����Q1 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������������������������ֱ���ȫȼ�գ����߷ų������� |
| B���ɡ���(ʯī)����(���ʯ)����H=1.9kJ/mol����֪�����ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У���+(aq)+OH-(aq)��H2O(l)����H=-57.3kJ/mol��������1molCH3COOH�뺬��mol NaOH����Һ��ϣ��ų�������С��57.3kJ |
| D����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)��2H2O(l)����H=��285.8kJ/mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com