
【题目】已知歧化反应:3NO2+H2O===2HNO3+NO,下列说法正确的是( )
A. 氧化产物与还原产物的物质的量之比为1∶2
B. 氧化剂与还原剂的物质的量之比为1∶2
C. 1 mol NO2与足量水反应转移电子个数为2NA
D. 每生成22.4 L NO,有2 mol NO2被氧化
【答案】B
【解析】
A.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸氧化产物,其计量数是2,生成NO是还原产物,其计量数是1,所以氧化产物与还原产物的物质的量之比为2∶1,选项A错误;B.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量之比是1:2,选项B正确;C.在反应中若有1mol NO2参与反应时,有![]() mol电子发生转移,选项C错误;D.没有说明标准状况下,22.4 L NO不一定为1mol,无法计算被氧化 NO2的物质的量,选项D错误;答案选B。
mol电子发生转移,选项C错误;D.没有说明标准状况下,22.4 L NO不一定为1mol,无法计算被氧化 NO2的物质的量,选项D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) ΔH =QkJ/mol(Q>0),则下列说法正确的是
2SO3(g) ΔH =QkJ/mol(Q>0),则下列说法正确的是
A. 2 molSO2(g)和1 mol O2(g)具有的能量小于2molSO3(g)具有的能量
B. 2molSO2(g)和1molO2(g)置于密闭容器中充分反应放出QkJ的热量
C. 2mol SO2(g)和1molO2(g)置于密闭容器中充分反应放出热量大于QkJ
D. 如将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热量QkJ,则此过程中有2 mol SO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与![]() ===
===![]() 相比较,水的作用不相同的是( )
相比较,水的作用不相同的是( )
A. ![]() ===
===![]() ↑
↑
B. ![]() ===
===![]()
C. ![]() ===
===![]()
D. ![]() ===
===![]() ↑
↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________________。当1 mol O2发生反应时,还原剂所失电子的物质的量为_________mol。
(2)焙烧明矾的化学方程式为4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2+48H2O,在该反应中,还原剂是_____________。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________。
(4)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
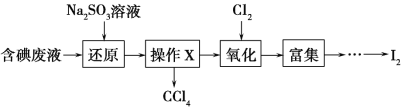
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_________________;该操作将I2还原为I-的目的是________________________。
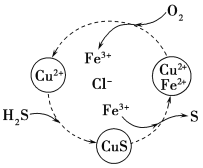
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是________________。
(6)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________,反应消耗1 mol NaBH4时转移的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A. 504mL B. 168mL C. 336mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在210℃达到平衡:
PCl5(g)![]() PCl3(g)+Cl2(g) △H >0 K=1 ①
PCl3(g)+Cl2(g) △H >0 K=1 ①
CO(g)+Cl2(g)![]() COCl2(g) △H <0 K=5×104 ②
COCl2(g) △H <0 K=5×104 ②
COCl2(g)![]() CO(g)+ Cl2(g) △H >0 ③
CO(g)+ Cl2(g) △H >0 ③
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示____________,K值大小与温度的关系是:温度升高,K值___________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是___________
A.c(PCl5) = c(PCl3)= c(Cl2)=1
B.c(PCl5)= c(PCl3)·c(Cl2)=1
C.c(PCl5)= c(PCl3)·c(Cl2)
(3)降低Cl2浓度,反应③的K值___________(填“增大”、“减少”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com