
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。
【答案】 NH3 < HF HClO4 KOH Al(OH)3 离子键、共价键 Al3+
NH3 < HF HClO4 KOH Al(OH)3 离子键、共价键 Al3+ ![]()
![]() Cl2 2NaBr+Cl2=2NaCl+Br2
Cl2 2NaBr+Cl2=2NaCl+Br2
【解析】
根据元素在周期表中的位置,各编号位置的元素如图所示。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ①N | ②F | ||||||
三 | ③Na | ④Mg | ⑤Al | ⑥Si | ⑦Cl | ⑧Ar | ||
四 | ⑨K | ⑩Br |
同主族元素从上到下,金属性增强,非金属性减弱;
同周期元素从左到右,金属性减弱,非金属性增强。
(1)最不活泼的元素,为0族元素,Ar最外层8个电子,已经达到稳定结构。根据核外电子排布规律,Ar电子层的电子数分别为2、8、8,所以其原子结构示意图为 ;
;
(2) 同周期元素从左到右,非金属性增强,非金属元素的气态氢化物的稳定性越来越强,①N元素,其氢化物NH3,②F元素,其氢化物为HF;稳定性排序为HF>NH3;
(3) 同主族元素从上到下,金属性增强,非金属性减弱;同周期元素从左到右,金属性减弱,非金属性增强。金属性越强,其最高价氧化物的水化物即碱的碱性越强,非金属性越强,其最高价氧化物的水化物即酸的酸性越强。在右上角可以找到非金属性最强的元素F,但是F没有其含氧酸,所以其最高价氧化物的水化物即酸的酸性最强的元素为Cl, Cl最高价为+7,对应的酸为HClO4。可以在左下角找到金属性最强的金属元素为K,K的最高价为+1,对应的碱为KOH。金属Al的最高价氧化物的水化物Al(OH)3具有两性。③代表的元素为Na,其最高价氧化物的水化物为NaOH,电子式为![]() ,Na+和OH-阴阳离子之间为离子键,OH-中的O和H之间为共价键,答案为HClO4 ;KOH ; Al(OH)3 ;离子键、共价键;
,Na+和OH-阴阳离子之间为离子键,OH-中的O和H之间为共价键,答案为HClO4 ;KOH ; Al(OH)3 ;离子键、共价键;
(4)离子半径的比较,一般情况下,粒子核外电子层排布中多一个电子层半径要大,因此Cl-,K+核外电子层有3层,Br-核外电子层有4层,半径比核外只有2个电子层的N3-、F-、Na+等半径大。N3-、F-、Na+、Mg2+、Al3+核外电子排布相同,均为2、8。核外电子排布相同的微粒,核电荷数越大,半径越小,因此Al3+核电荷数最大,半径最小,因此半径最小的为Al3+;
(5)Na最外层只有1个电子,O最外层有6个电子,Na失去一个电子形成Na+,变成稳定结构。O从Na得到1个电子,有7个电子,仍需共用一对电子才达到稳定结构,因此O和O之间形成一对共用电子对。因此Na2O2的电子式为![]() 。CO2中,C原子最外层有4个电子,不容易失去也不容易得到,需要共用4对电子对,才能达到稳定结构。O原子最外层为6个电子,达到稳定结构需要共用两对电子对,因此1个C原子和2个O原子,共用4对电子对达到稳定结构,CO2的电子式为
。CO2中,C原子最外层有4个电子,不容易失去也不容易得到,需要共用4对电子对,才能达到稳定结构。O原子最外层为6个电子,达到稳定结构需要共用两对电子对,因此1个C原子和2个O原子,共用4对电子对达到稳定结构,CO2的电子式为![]() ;
;
(6)同主族非金属元素其非金属性从上到下逐渐减小,Br的非金属性比Cl小,所以Br2的氧化性没有Cl2的氧化性强。可以利用氧化还原反应中氧化剂的氧化性大于氧化产物,有反应Cl2+2NaBr=2NaCl+Br2。答案为Cl2 Cl2+2NaBr=2NaCl+Br2。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质。下列说法错误的是( )
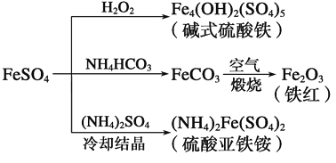
A. 碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3 分解,生产FeCO3需在较低温度下进行
C. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4 的大
D. 可用KSCN溶液检验(NH4)2Fe(SO4)2 是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
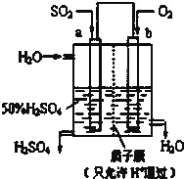
①上述生产硫酸的总反应方程式为_____,b是_____极,a电极反应式为_____,生产过程中H+向_____(填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____,溶液C为_____。
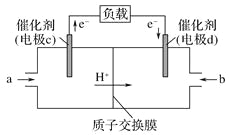
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知V(A)、V(B)、V(C)之间有以下关系2V(B)=3V(A),3V(C)=2V(B),则此反应可表示为( )
A.A+B=CB.A+3B=2CC.3A+B=2CD.2A+3B=2C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
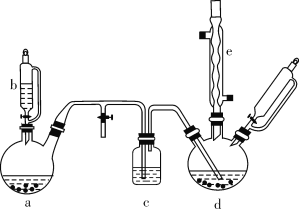
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《后汉书·郡国志》中记载:“石出泉水……其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”这里的“石漆”“石脂水”是指
A. 油脂 B. 油漆 C. 石油 D. 甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知歧化反应:3NO2+H2O===2HNO3+NO,下列说法正确的是( )
A. 氧化产物与还原产物的物质的量之比为1∶2
B. 氧化剂与还原剂的物质的量之比为1∶2
C. 1 mol NO2与足量水反应转移电子个数为2NA
D. 每生成22.4 L NO,有2 mol NO2被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com