
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
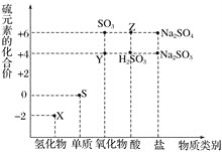
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_____________。
(3)检验物质Y的方法是______________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL 0.05mol·L-1的Na2SO3溶液与 20mL 0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
【答案】SO2、H2SO3、Na2SO3 1∶2 将Y通入品红溶液中,品红溶液褪色,加热后又变红色 ![]() b +3
b +3
【解析】
(1)处于元素高价态的微粒只具有氧化性,处于低价态只具有还原性,而处于中间价态的微粒具有氧化性和还原性;
(2)硫化氢具有还原性,二氧化硫既有氧化性又有还原性,硫化氢和二氧化硫发生氧化还原反应生成硫和水;
(3)SO2具有漂白性,能与有色物质生成不稳定的无色物质;
(4)浓硫酸与铜共热发生氧化还原反应生成硫酸铜、二氧化硫和水;
(5)Na2S2O3中S元素的化合价为+2价,若要用归中反应制备Na2S2O3,反应物中S元素的化合价必须有1个大于+2,有1个小于+2;
(6)由得失电子数目守恒计算可得。
(1)处于元素高价态的微粒只具有氧化性,处于低价态只具有还原性,而处于中间价态的微粒具有氧化性和还原性,由题给图示可知,硫元素处于中间价态的化合物有+4价的SO2、H2SO3、Na2SO3;
(2)硫化氢具有还原性,二氧化硫既有氧化性又有还原性,硫化氢和二氧化硫发生氧化还原反应生成硫和水,反应的化学方程式为2H2S+ SO2=3S+2H2O,由方程式可知氧化剂SO2与还原剂H2S的物质的量之比为1:2;
(3)SO2具有漂白性,能与有色物质生成不稳定的无色物质,则检验SO2的方法为将SO2通入品红溶液中,使品红溶液褪色,加热后又变红色;
(4)浓硫酸与铜共热发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的化学方程式为![]() ;
;
(5)Na2S2O3中S元素的化合价为+2价,若要用归中反应制备Na2S2O3,反应物中S元素的化合价必须有1个大于+2,有1个小于+2,a中两种物质中S元素化合价均小于+2,c、d中两种物质中S元素化合价均大于+2,只有b中S元素化合价1个大于+2,1个小于+2,故选b;
(6)设Cr元素在还原产物中的化合价为+a,由得失电子数目守恒可得24×10-3L×0.05 molL-1×2=20×10-3L ×0.02 mol·L-1×2×(6—a),解得a=3。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是
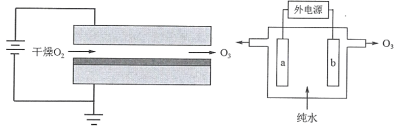
A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器为某些基本操作的部分仪器,请按照要求填空:
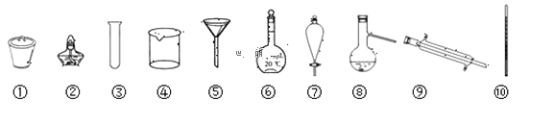
(1)写出仪器的名称:①________;⑦________;⑧________;
(2)上述仪器中,可以直接加热的仪器有________(填序号)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃),需要上述仪器中的(填序号)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置中提供的物质完成相关实验,最合理的选项是( )
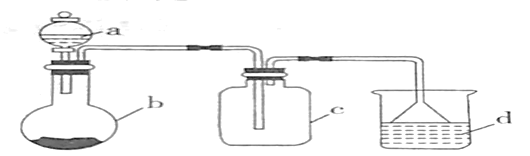
选项 | a中的溶液 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 生石灰 | NH3 | H2O |
B | 浓硝酸 | 铜片 | NO2 | H2O |
C | 稀硝酸 | 铜片 | NO | NaOH溶液 |
D | 浓硫酸 | 亚硫酸钠 | SO2 | NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:
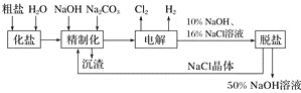
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
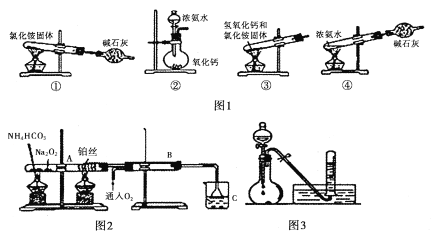
I. (1)图1为制取氨气的装置和选用的试剂,其中合理的是______________(填字母)。
A,①② B. ②③ C. ②④ D. ①③
(2)实验室制备氨气的化学方程式是____________________________________。
II. 图2位铵盐的受热分解装置
(1)被加热的铂丝处发生反应的化学方程式为____________________________________。
(2)B中出现的现象为_______________________________________________________。
(3)如图3:将上述烧杯C中反应得到酸的足量的浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示
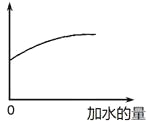
A. CO32-水解的平衡常数
B. 溶液的pH
C. 溶液中HCO3-的数目
D. 溶液中的c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
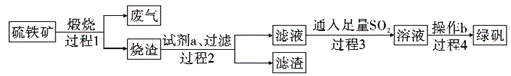
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com