
| A. | 浓硫酸稀释时溶液温度升高,说明浓硫酸稀释只有水合过程 | |
| B. | 蔗糖是非电解质,放入水中溶液温度没有明显变化,说明蔗糖溶于水既没有扩散过程也没有水合过程 | |
| C. | 家用石碱(Na2CO3•10H2O)久置后,由块状变成粉末状,这一变化是风化的结果 | |
| D. | 从冰箱中取出物品,表面很快出现水珠,这种现象叫潮解 |
分析 A.物质溶解过程中包括两个过程,一是物质扩散过程需要吸收热量,二是物质水合过程需要放出热量,溶解后溶液温度变化取决于二者相对大小;
B.蔗糖溶解过程中包括物质扩散过程和物质水合过程;
C.结晶水合物在常温时放在干燥的空气里,会逐渐失去结晶水的现象叫风化;
D.冰箱中冷藏的物品温度低,空气中的水蒸汽遇到温度低的物品液化成小水滴.
解答 解:A.物质溶解过程中包括两个过程,一是物质扩散过程需要吸收热量,二是物质水合过程需要放出热量,溶解后溶液温度变化取决于二者相对大小,浓硫酸稀释时溶液温度升高,说明扩散过程吸收热量小于水合过程放出热量,所以溶液温度升高,故A错误;
B.蔗糖溶解过程中包括物质扩散过程和物质水合过程,蔗糖放入水中溶液温度没有明显变化,是因为两个过程中热量变化相当,故B错误;
C.结晶水合物在常温时放在干燥的空气里,会逐渐失去结晶水的现象叫风化,所以家用石碱(Na2CO3•10H2O)久置后,失去结晶水,有块状变成粉末状,这一变化是风化的结果,故C正确;
D.冰箱中冷藏的物品温度低,空气中的水蒸汽遇到温度低的物品液化成小水滴,是一种液化现象,不是潮解,故D错误.
故选C.
点评 本题主要考查了物质溶解过程中的能量变化规律、潮解和风化的概念,题目难度不大,注意知识的积累,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:实验题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图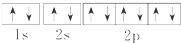 | B. | Na+的结构示意图: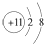 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热能要充分利用 | |
| B. | 燃料充分燃烧时输入的空气量越多越好 | |
| C. | 固体燃料燃烧前要粉碎 | |
| D. | 液体燃料燃烧时可以雾状喷出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
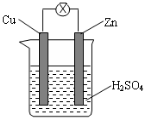
| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
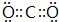 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式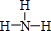 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
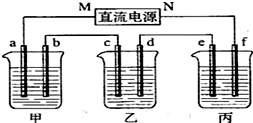
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中的溶质只有NH4Cl | |
| B. | 当溶液呈碱性时:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 该溶液可能由pH=12的氨水与pH=2的HCl溶液等体积混合而成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com