
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在,钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:

(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为________
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________________
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用 盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因是____________________
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式__________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是______________
【答案】 2Al+2OH-+2H2O![]() 2AlO2- + 3H2↑ 4Co2O3·CoO+ Na2S2O3+ 11H2SO4
2AlO2- + 3H2↑ 4Co2O3·CoO+ Na2S2O3+ 11H2SO4![]() 12CoSO4+ Na2SO4+11H2O Co2O3·CoO可氧化盐酸产生Cl2,污染环境 2Al3++3CO32-
12CoSO4+ Na2SO4+11H2O Co2O3·CoO可氧化盐酸产生Cl2,污染环境 2Al3++3CO32-![]() +3H2O
+3H2O![]() 2Al(OH)3↓+3CO2↑ 调整pH,提供CO32-
2Al(OH)3↓+3CO2↑ 调整pH,提供CO32-![]() ,使Co2+沉淀为CoCO3
,使Co2+沉淀为CoCO3
【解析】试题分析:(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,所以加入Na2S2O3的作用是还原Co3+,盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不能盐酸;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
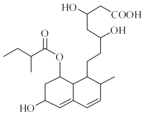
A. 能与FeCl3 溶液发生显色反应
B. 能使酸性KMnO4 溶液褪色,不能使溴水褪色
C. 能发生加成、取代、消去、氧化、还原反应
D. 1mol 该物质最多可与1mol NaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行可逆反应:2NO2(g)![]() 2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
A. 混合气体的颜色不再改变 B. 混合气体的密度不再改变
C. 混合气体的压强不再改变 D. 混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步反应直接完成的是( )
A.Al3+→Al(OH)3B.Al→AlO2-
C.Al(OH)3→Al2O3D.Al2O3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
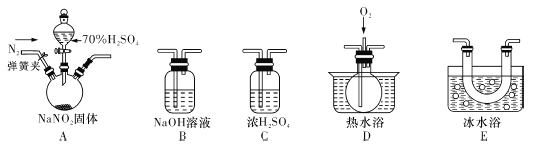
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会对人体健康造成较大危害的是
A.用SO2漂白木耳制成银耳
B.用漂白粉[Ca(ClO)2]稀溶液对餐具进行杀菌消毒
C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D.用小苏打(NaHCO3)发酵面团制作馒头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.H2O的摩尔质量为18g
B.3.01×1023个SO2分子的质量为32g
C.标准状况下,1 mol任何物质体积均为22.4L
D.将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是( )
A.6.72 L CO
B.6.6 g CO2
C.24 g SO3
D.9.8 g H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com