
下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4+ + OH—
NH4+ + OH—
B.100℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l)  H+(aq) + OH—(aq)
H+(aq) + OH—(aq)  H<0
H<0
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+
2Fe2+ + SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列物质的水溶液中,除了水分子外,不存在其他分子的是
A.HCl B.NH4NO3 C.Na2CO3 D.HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
把A、B、C、D四块金属泡在稀硫酸中,用导线两两相连可以组成各种原电池,若A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:实验题
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20mL。请回答下列问题:
(1)将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。

(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:


(1)反应
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
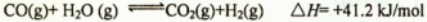
①下列事实能说明该反应达到平衡的是 ,
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是:
A.硫酸亚铁加过氧化氢溶液:Fe2+ + H2O2 + 2H+ Fe3+ + 4H2O
Fe3+ + 4H2O
B.将少量硝酸银溶液滴入氨水中:Ag+ + 2NH3·H2O [Ag(NH3)2]+ + 2H2O
[Ag(NH3)2]+ + 2H2O
C.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓
D.铝粉与NaOH的D2O溶液反应:2Al + 2OH- + 2D2O 2AlO2- + H2↑+2D2↑
2AlO2- + H2↑+2D2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:填空题
(14分)目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
【化学一一选修5:有机化学基础】(15分)
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应:F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应:M与NaOH溶液反应后的产物,其一氯代物只有一种。

请回答:
(1)B、F的结构简式分别为: 、 。
(2)反应①~⑦中,属于消去反应的是: (填反应序号)。
(3)D发生银镜反应的化学方程式为: ;反应⑦的化学方程式为: 。
(4)A的相对分子质量在180—260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为: 。
(5)写出符合下列条件F的所有同分异构体的结构简式 。
a.能发生银镜反应
b.能与FeCl溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com