
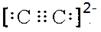
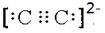 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.6个120° | B.5个108° | C.4个109°28′ | D.6个109°28′ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)查看答案和解析>>
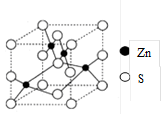
科目:高中化学 来源:不详 题型:单选题
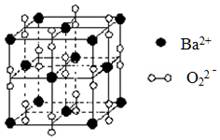
| A.与每个Ba2+距离相等且最近的Ba2+共有6个 |
| B.晶体中Ba2+的配位数为8 |
| C.晶体的化学式为Ba2O2 |
| D.该氧化物是含有非极性键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
查看答案和解析>>
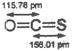
科目:高中化学 来源:不详 题型:单选题
| A.熔点1070℃,易溶于水,水溶液导电 |
| B.熔点10.32℃,液态不导电,水溶液导电 |
| C.能溶于CS2,熔点444.6℃ |
| D.熔点3550℃,很硬,不溶于水,不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com