
【题目】下列既是吸热反应,又是氧化还原反应的是( )
A.碳在高温下和二氧化碳的反应
B.碳不完全燃烧
C.氯化铵与氢氧化钡晶体的反应
D.铝和氧化铁在高温下的反应
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-![]() NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_____________________。
(2)反应中硝酸体现了_____、_____性质。
(3)若反应中转移的电子总数为0.15 NA(NA是阿伏加德罗常数的值),则产生的NO在标准状况下的体积是_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)写出对应装置中选用的物质:A______________________,B________________,C________________;
(2)其中装置B中所盛试剂的作用为___________________;C中反应的离子方程式为_______________________________。
(3)乙同学的实验原理是________________________________________________;写出B处的离子方程式:________________________________。
【答案】 石灰石(CaCO3) 饱和NaHCO3溶液 Na2SiO3溶液 除去CO2中的HCl气体 SiO+2CO2+2H2O===H2SiO3↓+2HCO-(CO2过量) 强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质 2I-+Cl2===2Cl-+I2、Br2+2I-===I2+2Br-
【解析】试题分析:通过比较酸性强弱来判断非金属性强弱,完成C与Si的非金属性强弱比较的实验,A装置制取二氧化碳,B装置除去二氧化碳中的氯化氢,C装置硅酸钠与二氧化碳反应证明碳酸的酸性大于硅酸;乙通过比较单质的氧化性来判断非金属性。
解析:根据以上分析,(1). 完成C与Si的非金属性强弱比较的实验,A装置制取二氧化碳,B装置除去二氧化碳中的氯化氢,C装置硅酸钠与二氧化碳反应证明碳酸的酸性大于硅酸;装置中选用的物质:A中放石灰石,B中盛放饱和NaHCO3溶液,C中盛放Na2SiO3溶液;(2)装置B中盛饱和NaHCO3溶液的作用是除去CO2中的HCl气体;C中硅酸钠与过量二氧化碳反应生成硅酸沉淀和碳酸氢钠,离子方程式为SiO+2CO2+2H2O===H2SiO3↓+2HCO-;(3)乙同学通过比较单质的氧化性来判断非金属性,实验原理是强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质,B处参与反应的气体有氯气和A处生成的溴蒸气,氯气与碘化钾反应生成氯化钾和碘单质的离子方程式是2I-+Cl2===2Cl-+I2,溴与碘化钾反应生成溴化钾和碘单质的离子方程式是Br2+2I-===I2+2Br-
【题型】实验题
【结束】
21
【题目】氢氧燃料电池是符合绿色化学理念的新型电池。电池装置如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

请回答下列问题:
(1)在导线中电子流动方向为______________(用a、b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因是__________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________,反应Ⅱ中的氧化剂是__________。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液.①甲中石墨棒上的电极反应式 , 电子的移动方向为 .
②乙中总反应的离子方程式为 , Cl﹣移向电极(填Fe或C).
③将湿润的淀粉﹣KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 . 若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为: .
(2)如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入CuO的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.糖类、油脂和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.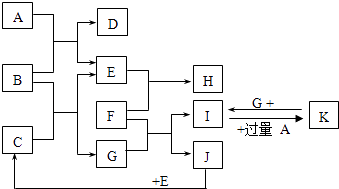
试回答下列问题:
(1)写出B的化学式: , 写出A的电子式;
(2)写出I→K的离子方程式;
(3)写出F与Fe3O4在高温下反应的化学方程式;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
A.0.1mol﹣NH2(氨基)中含有的电子数目为1.0NA
B.常温下,1L 0.1molL﹣1 CH3COONa溶液中含有的CH3COO﹣和Na+总数为0.2NA
C.标准状况下,2.24 LH2O中含有的原子总数为3NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com