【答案】
分析:I.(1)根据化学常用仪器、实验用品的使用方法来分析;
(2)根据实验中的操作顺序来分析;
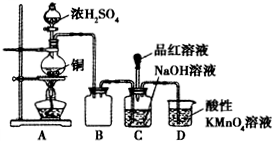
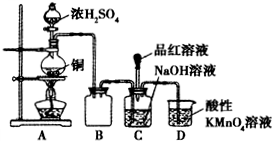
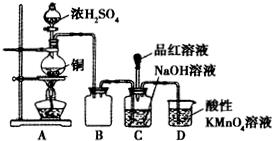
II.(1)圆底烧瓶中发生Cu与浓硫酸的氧化还原反应;
(2)浓硫酸具有强氧化性,稀硫酸不具有强氧化性,利用氧化还原反应来分析使Cu溶解的物质;
(3)装置B可防止碱液被吸入A装置中,二氧化硫能与高锰酸钾发生氧化还原反应;
(4)二氧化硫足量时,与碱反应生成NaHSO
3,再利用二氧化硫具有漂白性来分析.
解答:解:I.(1)①石蕊遇酸碱变色时需要在酸碱发生电离的情况下进行,则用蓝色石蕊试纸来检验气体性质时试纸应用蒸馏水润湿,故答案为:用蒸馏水润湿;
②容量瓶使用之前应先检查是否漏水,漏水的容量瓶不能用来配制溶液,故答案为:检验是否漏水;
③托盘天平使用之前应先调节天平平衡,否则称量的质量不准确,故答案为:游码归零,调节天平平衡;
(2)A.用排水法收集气体后,先移出导管,后熄灭酒精灯,是为了防止水倒吸,故A正确;
B.点燃可燃性气体(如CH
4、H
2、CO等)时,都要先检验气体纯度,后点燃,是为防止气体不纯而发生爆炸,故B正确;
C.碱液流到桌子上,先用稀醋酸溶液中和,后用水洗,降低碱性来减小腐蚀,故C正确;
D.给试管加热时,先均匀加热,后局部加热,是为防止试管局部受热而使试管炸裂,故D正确;
故答案为:ABCD;
II.(1)Cu与浓硫酸在加热时反应生成硫酸铜、二氧化硫和水,反应为Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O,
故答案为:Cu+2H
2SO
4(浓)
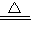
CuSO
4+SO
2↑+2H
2O;
(2)因随着反应进行,硫酸越来越稀,铜和稀硫酸不反应,所以有硫酸剩余,在酸性条件下,硝酸盐具有硝酸的强氧化性,能使Cu溶解,
也可利用酸性条件下产生的铁离子与Cu发生氧化还原反应使之溶解,则可加入NaNO
3、Fe
2O
3固体,
故答案为:随着反应进行,硫酸越来越稀,铜和稀硫酸不反应,所以有硫酸剩余;NaNO
3、Fe
2O
3;
(3)由图可知,装置B中的导管较短,则装置B可防止碱液被吸入A装置中,从而起到安全瓶(防止倒吸)的作用,二氧化硫有毒,不能排放在环境中,则D中的高锰酸钾与二氧化硫发生反应而使多余的二氧化硫被吸收,
故答案为:安全瓶(防止倒吸);吸收多余的SO
2;
(4)二氧化硫过量时,碱反应生成NaHSO
3,且过量的二氧化硫使品红褪色,故答案为:把品红溶液滴入C装置反应后的溶液中,若品红溶液褪色,证明NaOH溶液全部转化为NaHSO
3.
点评:本题考查实验的基本操作和实验室制取二氧化硫及二氧化硫的性质,综合性较强,但难度不大,注重对基础知识的考查.


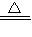 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,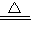 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;