
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法不正确的是( )
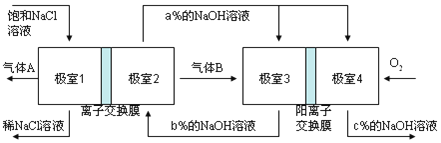
A. 气体B为H2
B. 相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2
C. 极室1 与极室2之间的离子交换膜也为阳离子交换膜
D. 溶液a、b、c的pH大小顺序为:a>b>c
【答案】D
【解析】
因为图示为电解池与燃料电池的组合,故通入氧气的一极(极室4)为燃料电池的正极,所以极室3为燃料电池的负极,极室2生成碱液,所以极室2为电解池的阴极,极室1为电解池阳极。所以气体A为氯气、气体B为氢气。
A.电解池中生成氢气的一端为电解池的阴极,溶液中氢离子得到电子生成氢气,在氢氧化钠溶液中,电解池的阴极反应式为2H2O+2e-=H2↑+2OH-,所以气体B为H2,故A正确;
B.根据反应O2+4e-+2H2O=4OH-、4Cl--4e-=2Cl2↑及电子守恒可得:2Cl2~O2,则相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2,故B正确;
C.极室1进去的饱和NaCl溶液,排出的是稀NaCl溶液,所以极室1 为阳极,反应式为2Cl--2e-=Cl2↑,钠离子移向极室2,所以极室1 与极室2之间的离子交换膜也为阳离子交换膜,故C正确;
D.燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b,故D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得
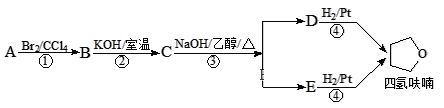
已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含氧官能团为醚键
B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色
D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
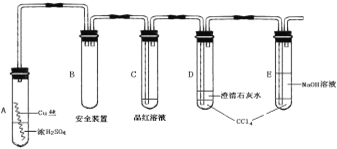
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
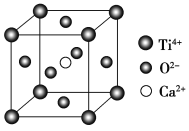
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
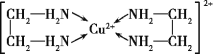
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/L NH4HCO3 溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
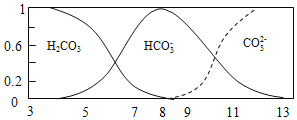
A. 常温下,Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11 时,随着pH值的增大,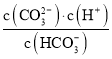 增大
增大
D. pH=3时,有c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe2+、Fe3+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
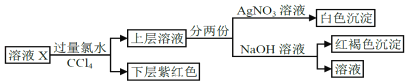
A. “下层紫红色”为I2的CCl4溶液,可用分液方法分离
B. 溶液X中有Fe2+、I﹣,可能有SO42﹣、Cl﹣、K+、Na+
C. 溶液X中一定有I﹣、Cl﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
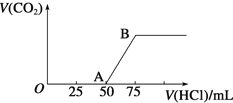
A. OA段所发生反应的离子方程式:H+ + OH-= H2O
B. 产生的CO2体积(标准状况下)为0.056L
C. 原NaOH溶液的物质的量浓度为0.75mol·L-1
D. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com