
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
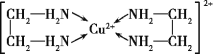
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
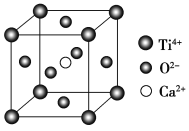
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
【答案】3d24s2 3 Si、S、P C—C键和C—H键较强,所形成的烷烃稳定;而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成 平面正三角形 abd 11 sp3 6 12 ![]() ×
×![]() ×107
×107
【解析】
(1)基态Ti原子核外有22个电子,其价电子排布式为3d24s2,基态Ti原子能量最高的能级为3d轨道,还有3个空轨道,由于原子半径:Si>P>O,又P的3p轨道为3p3半充满状态,故第一电离能:Si<S<P,故答案为:3d24s2;3;Si、S、P;
(2)根据表格数据分析可知,C—C键和C—H键较强,所形成的烷烃稳定;而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成,从而导致硅烷在种类和数量上都远不如烷烃多,故答案为:C—C键和C—H键较强,所形成的烷烃稳定;而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成;
(3)CO32-的成键电子对数![]() ,不含有孤对电子,则CO32-的空间构型为平面三角形,故答案为:平面三角形;
,不含有孤对电子,则CO32-的空间构型为平面三角形,故答案为:平面三角形;
(4)由该配离子结构图分析可知,该配离子中N原子和Cu2+形成配位键,C原子和N、H原子形成极性键,C原子和C原子形成非极性键,则选abd,一个乙二胺分子中共有11个σ键,C原子形成的都是单键,则其杂化方式为sp3,故答案为:abd;11;sp3;
(5)根据晶胞结构结构图可知,Ca2+位于晶胞体心,O2-位于晶胞各个面的面心,Ti4+位于晶胞的8个顶点上,所以Ca2+的配位数为6,与Ti4+距离最近且相等的O2-有2个,在一个晶胞中,含有Ti4+的个数![]() ,Ca2+个数为1,O2-的个数为
,Ca2+个数为1,O2-的个数为![]() ,即一共晶胞中含有1个CaTiO3,其质量为:
,即一共晶胞中含有1个CaTiO3,其质量为:![]() ,所以晶胞的体积
,所以晶胞的体积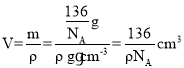 ,则晶胞的边长
,则晶胞的边长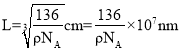 ,最近的Ti4+和O2-之间的距离
,最近的Ti4+和O2-之间的距离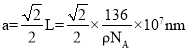 ,故答案为:6;12;
,故答案为:6;12;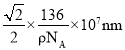 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。

⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① Fe + H2SO4(稀) ![]() FeSO4 + H2↑
FeSO4 + H2↑
② CuO + H2 ![]() Cu + H2O
Cu + H2O
③ MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
试回答下列问题:
(1)反应①中_________作氧化剂(填化学式),___________是氧化产物(填化学式);若有2mol Fe完全反应,转移的电子数为________ mol。
(2)用双线桥法表示反应②电子转移的方向和数目:________
(3)反应③中HCl体现了_________________性和_______________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
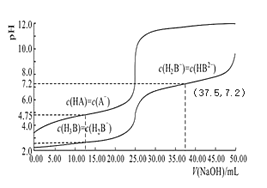
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.1 mol羟基(-OH)中含7NA个电子
B.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.6.2g白磷(分子式为P4)中所含P—P键的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法不正确的是( )
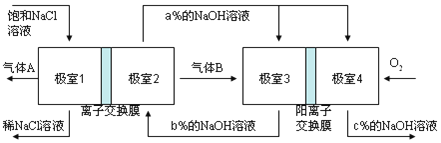
A. 气体B为H2
B. 相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2
C. 极室1 与极室2之间的离子交换膜也为阳离子交换膜
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿物的主要成分X(仅含三种元素)的组成,某兴趣小组进行了如下实验:
①取55.2g固体X在空气存在下高温煅烧,有刺激性气味的气体产生(标况下为13.44L),该气体能使品红溶液褪色。
②高温煅烧后的固体用磁分离技术进行分离,得到19.2g红色固体单质和23.2g黑色固体。
③将23.2g固体溶于稀硫酸,再加氢氧化钠,将所得沉淀充分灼烧,得到24g红棕色固体。已知各步反应试剂均过量,请回答:
(1)X化学式为______
(2)写出X在空气存在下高温煅烧的化学反应方程式______
(3)写出X高温煅烧后的气体通入碘水中发生的离子反应方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的应用不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com