
����Ŀ����������������Ҫ�Ĺ���Ԫ�ء�
(1)��λ��Ԫ�����ڱ��������ڢ��壬���̬ԭ����δ�ɶԵ��Ӹ���Ϊ___________��
(2)��̬Fe3+�ĺ�������Ų�ʽ___________
(3)��������һ�ִ��Բ��ϣ���ҵ���Ʊ�ʱ������ˮ�ⷨ���Ʊ�ʱ����������(CO(NH2)2)�������Ƶȼ������ʡ����ط����������ǽ���Ԫ�صĵ縺���ɴ�С��˳����___________����������������������Ŀ֮��Ϊ___________����������̼ԭ�ӵ��ӻ�����___________��
(4)������Ҳ��ʹ�ó��������Ʊ�ʱ�����백(NH3)������(N2H4)�������֪��(NH3�۵㣺��77.8%�桢�е㣺��33.5%��)������(N2H4�۵㣺2�桢�е㣺113.5��C)�������۷е�ߵ͵���Ҫԭ��______________________��
(5)Co(NH3)5BrSO4���γ������ܵ�������֪Co3+����λ��Ϊ6��Ϊȷ����������Ľṹ���ֶ�����������������ʵ�飺�ڵ�һ���������Һ�м�����������Һ������ɫ���������һ������������Ϊ___________���ڵڶ����������Һ�м�����������Һ��������ɫ��������ڶ�������������Ϊ___________��

(6)��������̼�ܽ���r-Fe���γɵ�һ�ּ�϶�����壬���ԣ��侧��Ϊ���������ṹ������ͼ��ʾ��������ʵĻ�ѧʽΪ___________����Ʒ���ܶ�Ϊdg��cm��3���������������̼ԭ�ӵľ���Ϊ___________pm(�����ӵ�������ֵ��NA��ʾ��д����ļ���ʽ����)��
���𰸡�3 1s22s22p63s23p63d5����[Ar]3d5�� O>N>C>H 7:1 sp2 ��sp3 �������Ӽ��γ��������Ŀ���ڰ������γɵ���� NH3��Br- NH3�� SO42- FeC��Fe4C4�� ![]()
��������
��1����������Ԫ�����ڱ���λ�ã����������Ų�ʽ�ж�δ�ɶԵ��Ӹ�����
��2�����ݻ�̬Fe�ĺ�������Ų�ʽ�ж�ʧȥ�����3�����Ӻ�ĵ����Ų�ʽ��
��3��CO(NH2)2������C��N��H��Oԭ�ӹ��ɣ�����ͬһ����Ԫ�ص縺����������ͬһ����Ԫ�ص縺����С�Ĺ��ɽ��з��������۵�����1���Ҽ�������˫����1���Ҽ���1���м�����ϳɼ����ɼ�����ӽṹʽ�������𣻴����ƺ�������̼��˫��������ӻ�������۽��з�����
��4��������������ʵ��۷е��Ӱ�죻
��5�������������ڽ�֮��ͨ���γ����Ӽ����������ӿ��Ե��룬���ڽ�������������Ե��롣
��1������27��Ԫ�أ�λ��Ԫ�����ڱ��������ڢ��壬���̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d74s2������3d�ܼ���ԭ�ӹ������3��δ�ɶԵ��ӣ�
�ʴ�Ϊ��3��
��2����Feԭ������Ϊ26��λ�ڵ������ڢ��壬���̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d64s2�����̬Fe3+�ĺ�������Ų�ʽ1s22s22p63s23p63d5����[Ar]3d5����
�ʴ�Ϊ��1s22s22p63s23p63d5����[Ar]3d5����
��3��ͬһ�����д�����Ԫ�صĵ縺����������ͬһ����Ԫ�ش��ϵ��µ縺����С����C��N��H��O�ĵ縺���ɴ�С��˳����O>N>C>H��CO(NH2)2�Ľṹ��ʽΪ��![]() ���ɿ��������ڹ���7���Ҽ���1���м�����Ҽ���м��ĸ�����Ϊ7:1����������ӵ�����̼ԭ�Ӳ��ṩ�¶Ե��ӣ��������������̼ԭ�Ӵ�������λ��,��̼ԭ��sp3�ӻ�,�Ȼ�̼ԭ��sp2�ӻ��������ӻ�����Ϊsp2 ��sp3��
���ɿ��������ڹ���7���Ҽ���1���м�����Ҽ���м��ĸ�����Ϊ7:1����������ӵ�����̼ԭ�Ӳ��ṩ�¶Ե��ӣ��������������̼ԭ�Ӵ�������λ��,��̼ԭ��sp3�ӻ�,�Ȼ�̼ԭ��sp2�ӻ��������ӻ�����Ϊsp2 ��sp3��
�ʴ�Ϊ��O>N>C>H��7:1��sp2 ��sp3��
��4��N2H4��NH3��ȣ�����Ӽ�������Ŀ�ϰ������γɵ�����࣬��N2H4�۷е��������ߣ�
�ʴ�Ϊ���������Ӽ��γ��������Ŀ���ڰ������γɵ������
��5��Co(NH3)5BrSO4���γ������ܵ�������֪Co3+����λ��Ϊ6���ڵ�һ���������Һ�м���������Һ������ɫ��������ɫ��������������˵����һ�����岻�����������������������ӣ������������ڽ�����壬���һ������������ΪNH3��Br-���ڵڶ����������Һ�м�����������Һ��������ɫ�����������Ϊ�廯���������岻������Br-������һ������������ΪNH3��SO42-��
�ʴ�Ϊ��NH3��Br-��NH3��SO42-��
��6�����ݾ����ṹ��֪����������ԭ�Ӹ���Ϊ8��1/8+6��1/2 = 4��̼ԭ�Ӹ���Ϊ1+12��1/4 = 4����˸����ʵĻ�ѧʽΪFeC��Fe4C4�������������������̼ԭ��֮��ľ���Ϊ��Խ��ߵ�һ�룬�����ı߳� = ![]() =
= ![]() cm������Խ���Ϊ
cm������Խ���Ϊ![]() cm��
cm��![]() �����Ծ����������̼ԭ��֮��ľ��� =
�����Ծ����������̼ԭ��֮��ľ��� =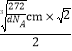 =
= ![]() pm��
pm��
�ʴ�Ϊ��FeC��Fe4C4����![]() pm��
pm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeBr2��Һ��ͨ��Cl2ʱ����μӷ�ӦCl2���ʵ����ı仯����Һ��ijЩ���ӵ�Ũ�ȱ仯�����ͼ��ʾ������˵������ȷ����

A.��n(Cl2)��M molʱ�����������ӷ�Ӧ��2Fe2����Cl2=2Fe3����2Cl�D
B.��n(Cl2)��M molʱ������Ũ�ȹ�ϵ��c(Fe3��)�Uc(Br��)�Uc(Cl��)��1�U2�U2
C.��n(Cl2)��2M molʱ������Ũ�ȴ�С��ϵ��c(Cl��)��c(Br��)
D.��Br�D��ʼ������ʱ��ͨ��Cl2�����ʵ���С��ԭFeBr2�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5(g) ![]() 4NO2(g)��O2(g)��H>0��T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
4NO2(g)��O2(g)��H>0��T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.53 | 2.50 | 2.50 |
����˵���в���ȷ���ǣ�
A. T1�¶��£�500sʱO2��Ũ��Ϊ0.74mol/L
B. ƽ������������䣬�����������ѹ����ԭ����1/2������ƽ��ʱc(N2O5)>5.00 mol/L
C. T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1>T2����K1<K2
D. T1�¶��µ�ƽ�ⳣ��ΪK1=125��ƽ��ʱN2O5��ת����Ϊ0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ������T��������������������������ȣ�����������ȷ����

A.���Ӱ뾶��Tm+��Wn��B.�ǽ����ԣ�Q��R
C.R���⻯���ˮ��Һ������D.Q�������ﶼ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȱ��͵������������Խ������Σ����Ŀǰ�ӵ�ʳ���е�Ԫ�ؾ�����IO3-���ڣ�������I-���ڡ���ʹ��Na2S2O3��ij������Ʒ�е�Ԫ�صĺ������вⶨ��
I��I-�Ķ��Լ��
��1��ȡ����������Ʒ���Թ��У���ˮ�ܽ⡣�μ������ữ���ٵμ�����5%NaNO2�͵��۵Ļ����Һ������Һ��________ɫ�������I-��ͬʱ����ɫ��������������������ɫ����д���÷�Ӧ�����ӷ���ʽΪ ___________________________________��
������������Ƶ��Ʊ�
��ҵ�Ʊ���������Ƶķ�Ӧԭ��Ϊ2Na2S + Na2CO3 +4SO2 =3Na2S2O3 +CO2��ij��ѧ��ȤС��������ԭ��ʵ�����Ʊ��������������ͼ��

�ȹر�K1��K2����Һ©����������Ũ���ᣬ���ƺ÷�Ӧ���ʡ�
��2��y��������___________ ����ʱBװ�õ�������___________________________��
��3����Ӧ��ʼ��C�����е���ɫ����,���ֱ�Ϊ���壬�˻�����Ϊ____________��(�ѧʽ��װ��D��������____________________________________��
��4��ʵ������ر�K2��K1������Һ���x����ʢҺ�����Ϊ________(����ţ�
A��NaOH��Һ B��Ũ���� C������NaHSO3��Һ
�����⺬���IJⶨ
��֪������ȡ10.00g��Ʒ������250mL��ƿ�У���ˮ100mL�ܽ⣬��2mL���ᣬҡ�ȡ�
���μӱ�����ˮ����Һ����dz��ɫ���ߵμӱ�ҡ������ɫ����ȥΪֹ��Լ1mL����
��������У���ȥ�������壬�ټ������5min��������ȴ����������15%�⻯����Һ��ҡ�ȡ�
����������������Һ��ָʾ��������0.002mol/L��Na2S2O3����Һ�ζ����յ㡣
���ظ����Σ�ƽ������Na2S2O3��Һ9.00mL
��ط�ӦΪ��I����3Br2��3H2O = IO3����6H+��6Br��
IO3����5I����6H+ = 3I2��3H2O
I2+2S2O32��= 2I����S4O62��
��5��������������ݼ���õ��κ�����Ϊ_______ mg��kg��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ҽҩ��ҵ�����ںϳ�ͷ������������ƥĪ�ֵȵ��м��壬����·���Ǻϳɿ������ἰ���������һ�ַ�����

(1)��д��B�Ľṹ��ʽ_____��C�й����ŵ�����Ϊ_____��
(2)��Ӧ�ٵķ�Ӧ����Ϊ_____��D�ĺ˴Ź���������_____��塣
(3)1molE��������_____molNaOH��Ӧ����Ӧ�۵Ļ�ѧ����ʽΪ_____��
(4)����C���ӿ��Է�Ӧ���ɾ���������Ԫ���Ļ�����F����F�Ľṹ��ʽΪ_____��
(5)д����������������C��ͬ���칹��Ľṹ��ʽ_____��
A�����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
B����FeCl3������ɫ
C�������Ͼ�������λ�ڶ�λ��ȡ����
(6)��֪��RCH2COOH![]() RCHClCOOH�����Ա�����Ϊԭ�ϣ����Լ���ѡ������Ʊ����Ҵ��ᣨ
RCHClCOOH�����Ա�����Ϊԭ�ϣ����Լ���ѡ������Ʊ����Ҵ��ᣨ![]() ���ĺϳ�·��_____��
���ĺϳ�·��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���W�ڹ�ҵ�ϳ������ܼ������ϣ���ϳɷ������£�

����˵����ȷ����
A. M��N��W���ܷ����ӳɷ�Ӧ��ȡ����Ӧ
B. N��W��������һ��CH2ԭ���ţ����Ի�Ϊͬϵ��
C. W����֬�����ܷ���������Ӧ
D. M�Ķ��ȴ�����8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѽ���A������B(NO3)2����Һ�У��������·�Ӧ��A+B2+=A2++B������������ȷ���ǣ� ��
A.�����½���Aһ������ˮ��Ӧ��Bһ��������ˮ��Ӧ
B.A��B�õ������Ӻ����ƾ��У�һ���γ�ԭ���
C.A��B�õ������Ӻ����B(NO3)2����Һ�У�һ���е�������
D.��A��B�γɵ�ԭ��أ�Aһ����������Bһ���Ǹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȷ�Ӧ���ǣ� ��
A.�������������ᷴӦB.������������ȼ��
C.����������ˮ��ӦD.Ba(OH)2��8H2O��NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com