
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。

⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
【答案】1s22s22p1 b、c 平面三角形 层状结构中没有自由移动的电子 sp3 高温、高压 2
【解析】
B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形成平面六边形结构,向平面发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;B原子的电子全部成键,晶体中没有自由移动的电子,不导电.立方相氮化硼每个B原子与4个N原子相连,每个N与4个B原子相连,构成正四面体,向空间发展形成网状结构.B原子的杂化方式为sp3,由于六方相氮化硼比立方相氮化硼稳定,立方相氮化硼的天然矿物在青藏高原在下约300Km的古地壳中被发现,说明由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压.根据配位键理论,NH4BF4有1个N-H和一个B-F属于配位键。
(1)基态硼原子核外有5个电子,分别位于1s、2s、2p能级,根据构造原理知其基态的电子排布式1s22s22p1,故答案为:1s22s22p1;
(2)a.立方相氮化硼N原子和B原子之间只存在共价单键,N和B的价电子全部参与成键,所以该化合物中含有σ键,不存在π键,故错误;
b.六方相氮化硼层间为分子间作用力,作用力小,导致其质地软,故正确;
c.非金属元素之间易形成共价键,所以N原子和B原子之间存在共价键,故正确;
d.立方相氮化硼为空间网状结构,不存在分子,为原子晶体,故错误;
故选bc;
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,所以硼原子与相邻氮原子构成的空间构型为平面三角形。该物质的层状结构中不存在自由移动的电子,所以不导电,故答案为:平面三角形;层状结构中没有自由移动的电子;
(4)立方相氮化硼晶体中,硼原子和四个N原子形成4个共价单键,所以B原子的杂化轨道类型为sp3,在地壳内部,离地面越深,其压强越大、温度越高,根据题干知,实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压,故答案为:sp3;高温高压;
(5)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,故答案为:2。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得
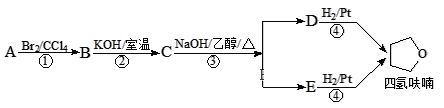
已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含氧官能团为醚键
B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色
D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
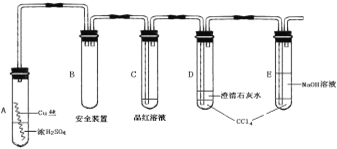
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
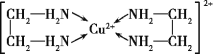
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
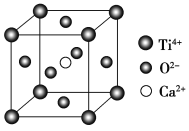
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe2+、Fe3+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
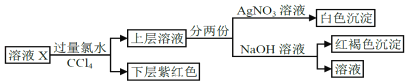
A. “下层紫红色”为I2的CCl4溶液,可用分液方法分离
B. 溶液X中有Fe2+、I﹣,可能有SO42﹣、Cl﹣、K+、Na+
C. 溶液X中一定有I﹣、Cl﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com