
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
【答案】 4CuCl + O2+ 8H2O![]() 2Cu2(OH)2Cl2·3H2O Fe2+ n(Cl-)=n(AgCl)×
2Cu2(OH)2Cl2·3H2O Fe2+ n(Cl-)=n(AgCl)×![]() =
=![]() =4.800×10-3mol
=4.800×10-3mol
n(Cu2+)=n(EDTA)×![]()
=0.08000 mol·L-1×30.00 mL×10-3 L·mL-1×![]() =9.600×10-3 mol
=9.600×10-3 mol
n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3 mol-4.800×10-3 mol=1.440×10-2 mol
m(Cl-)=4.800×10-3 mol×35.5 g· mol -1 =0.1704 g
m(Cu2+)=9.600×10-3 mol×64 g· mol -1 =0.6144 g
m(OH-)=1.440×10-2 mol×17 g· mol -1 =0.2448 g
n(H2O)= ![]() =4.800×10-3 mol
=4.800×10-3 mol
a∶b∶c∶x = n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1
化学式为Cu2 (OH)3Cl·H2O。
【解析】(1)①分析CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,可以发现Cu元素的化价升高了,所以氧气肯定做了该反应的氧化剂,根据化合价升降总数相等并结合质量守恒定律,可以写出该反应的化学方程式为4CuCl + O2+ 8H2O![]() 2Cu2(OH)2Cl2·3H2O。
2Cu2(OH)2Cl2·3H2O。
②由催化原理示意图可知, M'先与H+、O2反应生成M,M再被Cu还原为Cu2+,所以M'的化学式为Fe2+。
(2)由实验②可以求出该样品中所含Cl-的物质的量,由氯离子守恒得:
n(Cl-)=n(AgCl)×![]() =
=![]() =4.800×10-3mol
=4.800×10-3mol
由实验③结合反应信息Cu2++ H2Y2-![]() CuY2-+2H+,可以求出样品中所含Cu元素的物质的量:
CuY2-+2H+,可以求出样品中所含Cu元素的物质的量:
n(Cu2+)=n(EDTA)×![]()
=0.08000 mol·L-1×30.00 mL×10-3 L·mL-1×![]() =9.600×10-3 mol
=9.600×10-3 mol
再由化合物中电荷守恒得:
n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3 mol-4.800×10-3 mol=1.440×10-2 mol
分别求出这3种离子的质量,根据质量守恒,求出H2O的质量:
m(Cl-)=4.800×10-3 mol×35.5 g· mol -1 =0.1704 g
m(Cu2+)=9.600×10-3 mol×64 g· mol -1 =0.6144 g
m(OH-)=1.440×10-2 mol×17 g· mol -1 =0.2448 g
再求出结晶水的物质的量:
n(H2O)= ![]() =4.800×10-3 mol
=4.800×10-3 mol
最后求出各粒子的个数之比,写出化学式:
因为a∶b∶c∶x = n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1 ,所以该样品的化学式为Cu2 (OH)3Cl·H2O。


科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(H00C-COOH)。其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列说法正确的是

A. 每消耗0.1mol乙二醛在Pt1极放出2.24L气体(标准状况)
B. Pt1的电极反应为:4OH--4e-=2H2O+O2↑
C. 每得到lmol乙二酸将有2molH+从右室迁移到左室
D. 盐酸是起提供Cl-和增强导电性的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示戊烷燃烧热的热化学方程式正确的是
A.C5H12(l)+8O2(g)===5CO2(g)+6H2O(l) ΔH=3 540 kJ·mol1
B.C5H12(l)+8O2(g)===5CO2(g)+6H2O(g) ΔH=3 540 kJ·mol1
C.C5H12(l)+8O2(g)===5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol1
D.C5H12(l)+8O2(g)===5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃分子里的卤素原子与活泼金属或其阳离子结合,发生下列反应(X表示卤素原子):
R—X+2Na+X—R′![]() R—R′+2NaX
R—R′+2NaX
R—X+NaCN![]() R—CN+NaX
R—CN+NaX
根据下列各物质的转化关系填空:

(1)E的结构简式是______________。
(2)B→D的化学方程式是________________________。
(3)C→F的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
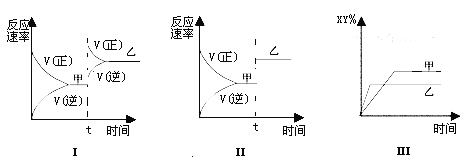
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1 NA
D. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10 NA
)数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A. 植物油的主要成分是不饱和高级脂肪酸甘油酯
B. 尼龙绳、宣纸均可由合成纤维制造
C. 淀粉和纤维素都是人体中能量的重要来源
D. 酶是生物体内重要的催化剂,仅由碳、氢、氧三种元素组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com