
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内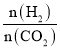 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
【答案】bc d ![]() ce
ce ![]() <
<
【解析】
I.(1) a.从能量图中分析可以,该反应过程的三步中,第一步吸热,二、三步均释放能量,a错误;
b.活化能的定义:活化分子的平均能量与反应物分子的平均能量之差。活化能越来大,活化分子所占的百分数就越小,反应越慢,第i步反应的活化能最大,决定总反应速率,b正确;
c.从题中三步反应可知,![]() 和
和![]() 是反应的中间产物,c正确。
是反应的中间产物,c正确。
故答案为:bc。
(2)若其他条件不变时,降低温度,正逆反应速率均减小,而浓度在那瞬间是不变的,所以k正、k逆均减小,再根据能量图,![]() 反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。故答案选:d。
反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。故答案选:d。
Ⅱ. (1)投料比 越大,根据反应
越大,根据反应![]() ,在相同温度时,相当于增大H2的浓度,
,在相同温度时,相当于增大H2的浓度,![]() 的平衡转化率更高,即
的平衡转化率更高,即![]() ,故答案为:
,故答案为:![]() ;
;
(2)若投料比![]() ,一定温度下:a.密度等于气体质量与容器体积的比值,在
,一定温度下:a.密度等于气体质量与容器体积的比值,在![]() 中,物质均为气体,保持压强为5MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;b.平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;c.
中,物质均为气体,保持压强为5MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;b.平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;c. ![]() 的体积分数即物质的量分数,反应前
的体积分数即物质的量分数,反应前![]() 的体积分数为50%,根据极极法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中
的体积分数为50%,根据极极法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中![]() 的体积分数始终保持为50%不变,故不能据此判断该反应是否达到平衡标志,c不能;d.容器内
的体积分数始终保持为50%不变,故不能据此判断该反应是否达到平衡标志,c不能;d.容器内 反应前为1:1,而反应中系数不是1:1,当容器内
反应前为1:1,而反应中系数不是1:1,当容器内 不再变化时,则该反应达到平衡,d能;e.断裂H—H键,生成水分子,均为正反应,不能说明正反应速率等于逆反应速率,e不能。故答案为:ce;
不再变化时,则该反应达到平衡,d能;e.断裂H—H键,生成水分子,均为正反应,不能说明正反应速率等于逆反应速率,e不能。故答案为:ce;
(3)若![]() ,则A点温度下,CO2的平衡转化率为50%,
,则A点温度下,CO2的平衡转化率为50%,
![]()
起: 1mol 3mol 0mol 0mol
转: 1×50%mol 1.5mol 0.25mol 0.75mol
平: 0.5mol 1.5mol 0.25mol 0.75mol
平衡时气体的总物质的量=(0.5+1.5+0.25+0.75)mol=3mol,则![]() =
=![]() ,
,![]() =
=![]() ,
,![]() ,
,![]() ,该反应的平衡常数
,该反应的平衡常数 =
= =
=![]() ;原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,
;原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,![]() 的转化率小于50%,故答案为:
的转化率小于50%,故答案为:![]() ,<。
,<。


科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯如图所示,下列说法正确的是
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的四种短周期元素,A、B、C、D为上述四种元素中的两种或三种所组成的化合物,E为单质。已知室温下,![]() 的水溶液pH为1,B分子中含有10个电子,D具有漂白性,五种化合物间的转化关系如图所示。下列说法正确的是( )
的水溶液pH为1,B分子中含有10个电子,D具有漂白性,五种化合物间的转化关系如图所示。下列说法正确的是( )

A.X、Y形成的二元化合物只有两种
B.Z元素在同周期元素中半径最小
C.W、Y组成化合物的沸点一定低于W、Z组成化合物的沸点
D.D中各原子均满足最外层![]() 稳定结构
稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 为原料,采用电解法制备电源TMAH[化学式
为原料,采用电解法制备电源TMAH[化学式![]() ]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )
]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )

A.a是电源正极
B.M为阴离子交换膜
C.![]() 中C、N原子均为
中C、N原子均为![]() 杂化
杂化
D.通过1mol电子时,电解池中可产生16.8L(STP)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
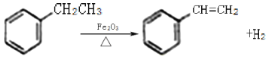
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。

⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Fe+CuSO4===FeSO4+Cu B. NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C. Cl2+H2O![]() HCl+HClO D. Fe2O3+3CO
HCl+HClO D. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
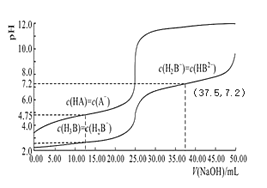
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )

A. 原子半径的大小顺序为:r(W)>r(Y)>r(Z)
B. 元素W的最高价氧化物对应的水化物是强酸
C. 元素Y和元素Z的最高正化合价相同
D. 气态氢化物的稳定性:X<Y<Z<W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com