
【题目】工业上可由乙苯生产苯乙烯如图所示,下列说法正确的是
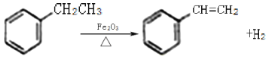
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
科目:高中化学 来源: 题型:
【题目】四水合磷酸锌[Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下,回答下列问题:
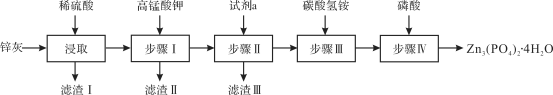
已知:6NH4HCO3 + 3ZnSO4 ![]() ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O + 2H3PO4 ![]() Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
(1)滤渣Ⅰ的主要成分为________;步骤Ⅰ中,需先将溶液的pH调至5.1,此时应选择的最佳试剂是________;
a.氨水 b.氢氧化钠 c.氧化锌 d.氢氧化钡
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为________;试剂a为________;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作包括________和干燥。
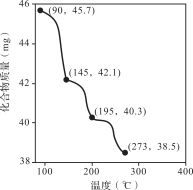
(2)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为________。
a.90~145℃ b.145~195℃ c.195~273℃ d.>273℃
(3)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2按1:1反应。
步骤Ⅰ:准确称取0.4570 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为________;产品中Zn3(PO4)2·4H2O的质量分数为_______。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
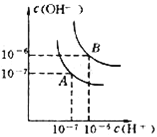
(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,2.24 L CH4中含有0.4NA个氢原子
C.1mol Fe与足量的盐酸反应制氢气,转移的电子数为3NA个
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列4个化学反应中,与其他3个反应类型不同的是( )
A. CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
B. CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
C. 2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
D. CH3CH2OH+HBr→CH3CH2Br+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内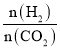 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com