
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列实验装置中,设计合理的是
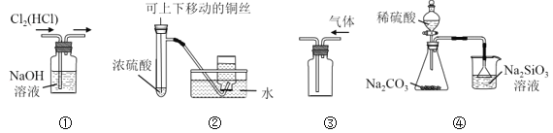
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯如图所示,下列说法正确的是
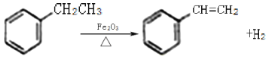
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
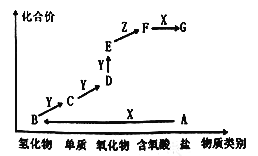
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
①CO2+C![]() 2CO ②Cu2(OH)2CO3
2CO ②Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
③Cl2+2NaOH=NaCl+NaClO+H2O ④2CO+O2![]() 2CO2
2CO2
⑤3Fe+4H2O(g)![]() Fe3O4+4H2 ⑥CuO+CO
Fe3O4+4H2 ⑥CuO+CO![]() Cu+CO2
Cu+CO2
⑦2H2O(g)![]() 2H2↑+O2↑ ⑧CO2+H2O =H2CO3
2H2↑+O2↑ ⑧CO2+H2O =H2CO3
(1)其中属于化合反应的有_____________(填序号,下同)。
(2)在化学反应前后元素的化合价没有变化的是___________________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_______________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是_____________。
(5)根据你的理解,氧化还原反应的实质是(____________)
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的四种短周期元素,A、B、C、D为上述四种元素中的两种或三种所组成的化合物,E为单质。已知室温下,![]() 的水溶液pH为1,B分子中含有10个电子,D具有漂白性,五种化合物间的转化关系如图所示。下列说法正确的是( )
的水溶液pH为1,B分子中含有10个电子,D具有漂白性,五种化合物间的转化关系如图所示。下列说法正确的是( )

A.X、Y形成的二元化合物只有两种
B.Z元素在同周期元素中半径最小
C.W、Y组成化合物的沸点一定低于W、Z组成化合物的沸点
D.D中各原子均满足最外层![]() 稳定结构
稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 为原料,采用电解法制备电源TMAH[化学式
为原料,采用电解法制备电源TMAH[化学式![]() ]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )
]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )

A.a是电源正极
B.M为阴离子交换膜
C.![]() 中C、N原子均为
中C、N原子均为![]() 杂化
杂化
D.通过1mol电子时,电解池中可产生16.8L(STP)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
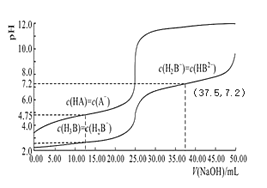
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com