
【题目】以![]() 为原料,采用电解法制备电源TMAH[化学式
为原料,采用电解法制备电源TMAH[化学式![]() ]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )
]是一种高效、绿色工艺技术。原理如图,M、N是离子交换膜。下列说法错误的是( )

A.a是电源正极
B.M为阴离子交换膜
C.![]() 中C、N原子均为
中C、N原子均为![]() 杂化
杂化
D.通过1mol电子时,电解池中可产生16.8L(STP)气体
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,2.24 L CH4中含有0.4NA个氢原子
C.1mol Fe与足量的盐酸反应制氢气,转移的电子数为3NA个
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得
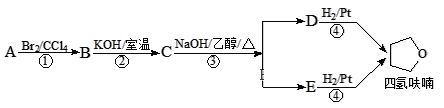
已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含氧官能团为醚键
B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色
D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若气态烃A的相对分子质量为26,根据下列转化关系推断:
A![]() B
B![]() C;A
C;A![]() D
D![]() E。
E。
(1)写出A~E的结构简式:
A_____B________C_________D_________E___________
(2)写出下列反应的化学方程式:
B ![]() C:_________。
C:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内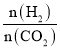 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
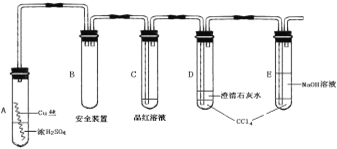
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com