
【题目】四水合磷酸锌[Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下,回答下列问题:
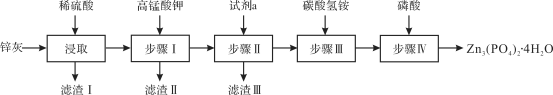
已知:6NH4HCO3 + 3ZnSO4 ![]() ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O + 2H3PO4 ![]() Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
(1)滤渣Ⅰ的主要成分为________;步骤Ⅰ中,需先将溶液的pH调至5.1,此时应选择的最佳试剂是________;
a.氨水 b.氢氧化钠 c.氧化锌 d.氢氧化钡
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为________;试剂a为________;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作包括________和干燥。
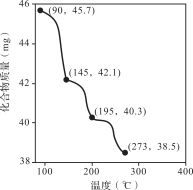
(2)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为________。
a.90~145℃ b.145~195℃ c.195~273℃ d.>273℃
(3)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2按1:1反应。
步骤Ⅰ:准确称取0.4570 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为________;产品中Zn3(PO4)2·4H2O的质量分数为_______。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
【答案】SiO2、PbSO4 c MnO+ 3Fe2+ + 7H2O=MnO2↓ + 3Fe(OH)3↓ + 5H+ Zn 过滤、洗涤 b 移液管(或酸式滴定管) 92% bd
【解析】
酸浸时SiO2不参与反应,PbO与稀硫酸反应生成难溶物质PbSO4;调节pH时应注意不能带入新的杂质;KMnO4与溶液中亚铁离子发生氧化还原反应,以此写出化学方程式;试剂a为了除去溶液中的其他金属阳离子;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作有过滤、洗涤、干燥,据此解答。
(1)酸浸时SiO2不参与反应,PbO与稀硫酸反应生成难溶物质PbSO4,故滤渣Ⅰ的主要成分为SiO2、PbSO4,;调节pH时不能带入新的杂质,也不能与所需产品反应,最佳试剂为氧化锌;KMnO4与溶液中亚铁离子发生氧化还原反应:![]() ;试剂a为了除去溶液中的其他金属阳离子Cu2+,为了不带入新的杂质,可用Zn单质;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作有过滤、洗涤、干燥;故答案为:SiO2、PbSO4;c;
;试剂a为了除去溶液中的其他金属阳离子Cu2+,为了不带入新的杂质,可用Zn单质;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作有过滤、洗涤、干燥;故答案为:SiO2、PbSO4;c;![]() ;Zn;过滤、洗涤;
;Zn;过滤、洗涤;
(2)由图可知当温度小于90℃时,产品为Zn3(PO4)2·4H2O,此时物质的量为![]() ,当温度为145℃时质量为42.1g,蒸发水分物质的量为
,当温度为145℃时质量为42.1g,蒸发水分物质的量为![]() ,则产品为Zn3(PO4)2·2H2O,同理可得,当温度为195℃时产品为Zn3(PO4)2·H2O,当温度为273℃时产品为Zn3(PO4)2,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,应控制温度在145~195℃,故答案为:b;
,则产品为Zn3(PO4)2·2H2O,同理可得,当温度为195℃时产品为Zn3(PO4)2·H2O,当温度为273℃时产品为Zn3(PO4)2,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,应控制温度在145~195℃,故答案为:b;
(3)移取溶液时所使用的玻璃仪器为移液管(或酸式滴定管);滴定时有关系:![]() ,消耗Na2H2Y物质的量为
,消耗Na2H2Y物质的量为![]() ,则样品中含有Zn3(PO4)2·4H2O的物质的量为:
,则样品中含有Zn3(PO4)2·4H2O的物质的量为:![]() ,则产品中Zn3(PO4)2·4H2O的质量分数为
,则产品中Zn3(PO4)2·4H2O的质量分数为![]() ;
;
a.步骤I中定容时俯视刻度线,导致产品浓度偏高,测定值偏高;
b.步骤I中转移溶液时未洗涤烧杯,导致产品浓度偏低,测定值偏低;
c.步骤II中滴定管未用Na2H2Y标准溶液润洗,所需标准液体积偏高,测定值偏高;
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡,所需标准液体积偏低,测定值偏低;故答案为:移液管(或酸式滴定管);92%;bd。


科目:高中化学 来源: 题型:
【题目】短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图转化关系(反应条件略去)。已知X、Y、Z均为双原子单质,X是空气中含量最多的气体,甲可使湿润的酚酞试纸变红,乙溶于水即得盐酸。请完成下列问题:

(1)X的电子式是_________________。
(2)写出甲和乙反应的化学方程式__________________。
(3)实验室可用如图所示的装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出收集甲的仪器装置简图。_______________
②试管中的试剂是________________(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)等pH、等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①开始反应时的速率A>B ②参加反应的锌的物质的量A=B
③反应所需要的时间B>A ④A中有锌剩余
(2)已知,CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
①温度不变,加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同),②若该溶液升高温度,下列表达式的数据增大的是_____。
A.c(H+) B.c(H+)·c(OH-)
C.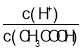 D.
D.![]()
(3)取0.10mol CH3COOH(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
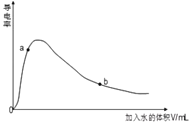
① n(H+):a_____b;
② c(CH3COO-):a_____b;
③完全中和时消耗NaOH的物质的量:a_____b;
(4)25℃时,部分物质的电离平衡常数如下表所示:
CH3COOH | H2CO3 | HCN |
1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 4.9×10﹣10 |
请回答下列问题:
① CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_________。
② 焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。请根据上述数据,尝试从理论上推测同为0.l molL-1的K2CO3溶液和HCN混合后,最可能发生的反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是![]()
![]()
A. ![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B. 固态![]() 是分子晶体,固态
是分子晶体,固态![]() 也是分子晶体
也是分子晶体
C. ![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D. ![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
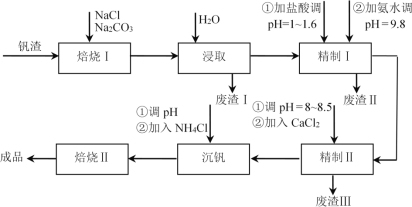
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO![]() +4H+=Al3++2H2O。
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)=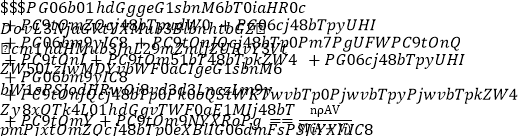 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中,设计合理的是
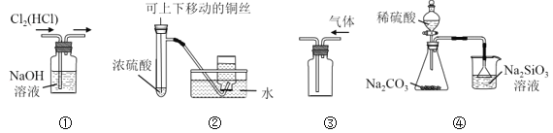
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯如图所示,下列说法正确的是
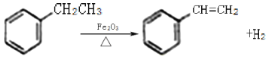
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com